题目内容
10.某城市有甲、乙两工厂排放污水,污水中各含有下列6种离子中的3种(两厂不含相同离子):H+、Ba2+、Na+、OH-、CO32-、NO3-.两厂单独排放都会造成严重的水污染,若将两厂的污水按一定比例混合,便会变成无色澄清只含硝酸钠的溶液.关于污染源的分析,你认为正确的是( )| A. | CO32- 和NO3- 来自同一工厂 | B. | OH-和NO3- 一定不在同一工厂 | ||
| C. | H+和Ba2+一定不在同一工厂 | D. | Na+和NO3- 来自同一工厂 |
分析 根据题意,甲、乙两工厂排放污水,污水中各含有下列6种离子中的3种(两厂不含相同离子),若将两厂的污水按一定比例混合,便会变成无色澄清只含硝酸钠的溶液.结合H+与OH-、CO32-不能共存,Ba2+与CO32-不能共存,据此进行分析解答.
解答 解:甲、乙两工厂排放污水,污水中各含有下列6种离子中的3种(两厂不含相同离子),若将两厂的污水按一定比例混合,便会变成无色澄清只含硝酸钠的溶液.H+与OH-、CO32-不能共存,则H+与OH-、CO32-不能在同一工厂;Ba2+与CO32-不能共存,则Ba2+与CO32-不能在同一工厂.即OH-、CO32-在同一工厂,H+、Ba2+在同一工厂,含有H+、Ba2+的工厂的阴离子应为NO3-,含有OH-、CO32-的工厂的阳离子应为Na+.
A、根据上述分析,CO32- 和NO3-不可能来自同一工厂,故选项说法错误.
B、根据上述分析,OH-和NO3- 一定不在同一工厂,故选项说法正确.
C、根据上述分析,H+和Ba2+一定在同一工厂,故选项说法错误.
D、根据上述分析,Na+和NO3-不可能来自同一工厂,故选项说法错误.
故选:B.
点评 本题实质上考查了离子共存的问题,判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水.

练习册系列答案
相关题目
18.下列物质能发生中和反应并产生沉淀的是( )
| A. | 硫酸和氢氧化钡 | B. | 盐酸和生石灰 | ||
| C. | 碳酸钠和氢氧化钡 | D. | 盐酸和硝酸银 |
15.下列对水的有关只是所做的总结:(1)水是由氢原子和氧原子构成的;(2)水是无色无味的液体;(3)4℃时,水的密度最大为1g/cm3;(4)水资源短缺已成为制约经济发展的重要因素之一.其中正确的是( )
| A. | 只有(2)(4) | B. | 只有(1)(2)(3) | C. | 只有(2)(3)(4) | D. | 只有(1)(2)(3)(4) |
19.现用质量分数为 98%的浓硫酸(密度是 1.84g•cm-3)配制 560g 质量分数为 14%的稀硫酸时,下列有关叙述正确的是( )
| A. | 配制稀硫酸时,用到的玻璃仪器只需量筒和烧杯 | |
| B. | 配制稀硫酸时,一定不能用天平称量所需浓硫酸的质量 | |
| C. | 将 480 mL 水倾倒入盛有 80 mL 98%浓硫酸的 500 mL 量筒中 | |
| D. | 将 80 g 98%的浓硫酸沿 1 000 mL 烧杯内壁缓缓倒入 480 mL 水中,并不断搅拌 |
8.继黄金、白金之后,钯金(Pd)首饰在市场上悄然兴起,为了获得钯金,取17.7%的PdCl2溶液100g,加入10.0g铁粉使其充分反应得到钯金和铁的氧化物,经分析所得钯金的质量为10.6g.未反应的铁粉质量为4.4g,下列说法正确的是( )
| A. | 生成铁的氯化物质量为12.7g | B. | 生成铁的氯化物质量为16.25g | ||
| C. | 生成铁的氯化物为FeCl2和FeCl3 | D. | 生成铁的氯化物为FeCl3 |
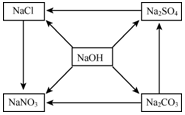 有五种化合物,它们两两之间发生的某些转化关系如图箭头所示.请回答:
有五种化合物,它们两两之间发生的某些转化关系如图箭头所示.请回答: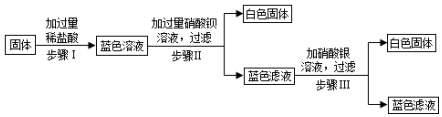
 在硫酸与硫酸铜的混合溶液200克中,滴入40%的氢氧化钠溶液100克,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化你溶液的质量关系如图所示.
在硫酸与硫酸铜的混合溶液200克中,滴入40%的氢氧化钠溶液100克,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化你溶液的质量关系如图所示.