题目内容
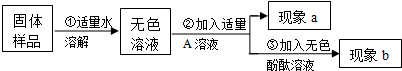
9.现欲探究一固体粉末状混合物A的成分,已知其中可能含有CuSO4、BaCO3、NH4NO3、Fe2O3、NaCl五种物质中的两种或多种.按下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应).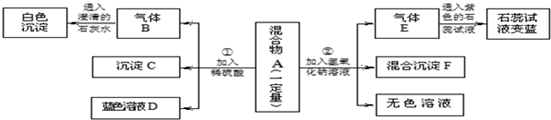
试根据实验过程和出现的现象做出判断,填写以下空白:
(1)①沉淀C的化学式为BaSO4,②气体E的化学式为NH3
(2)在混合物A中,肯定不存在的物质是Fe2O3 (写化学式)
(3)在混合物A中,可能存在的物质是NaCl (写化学式)
(4)溶液D中一定存在的金属阳离子为NH4+、Cu2+(写离子符号)
(5)写出实验过程②中生成沉淀的化学方程式:NH4NO3+NaOH=NH3↑+NaNO3+H2O.
分析 根据铵根离子和碱混合会生成氨气,氨气和水会生成氨水,氨水能使紫色石蕊显蓝色,碳酸盐和硫酸生成的二氧化碳和氢氧化钙反应会生成碳酸钙沉淀,氧化铁和稀硫酸反应会生成黄色的硫酸铁溶液、硫酸铜溶液为蓝色,硫酸铜和氢氧化钠反应产生沉淀等知识进行分析.
解答 解:铵根离子和碱混合会生成氨气,氨气和水会生成氨水,氨水能使紫色石蕊显蓝色,因此一定含有硝酸铵;碳酸盐和硫酸生成的二氧化碳和氢氧化钙反应会生成碳酸钙沉淀,因此一定含有碳酸钡;碳酸钡和硫酸反应产生硫酸钡沉淀,因此C是硫酸钡;溶液D为蓝色溶液,铜离子的盐溶液为蓝色,因此含有硫酸铜,氧化铁和稀硫酸反应会生成黄色的硫酸铁溶液,因此不含有氧化铁;硫酸铜和氢氧化钠反应产生氢氧化铜沉淀,因此:
(1)①沉淀C是碳酸钡和硫酸反应产生的硫酸钡沉淀,化学式为:BaSO4,②气体E是硝酸铵和氢氧化钠反应产生的氨气,化学式为:NH3;
(2)在混合物A中,肯定不存在的物质是氧化铁,因为氧化铁和硫酸反应产生的硫酸铁溶液是黄色的溶液,化学式为:Fe2O3;
(3)在混合物A中,肯定存在的物质是硫酸铜、碳酸钡、硝酸铵,所以在混合物A中,可能存在的物质是NaCl;
(4)由于硝酸铵和硫酸铜都不和硫酸反应,因此一定含有的阳离子有铜离子和铵根离子,化学符号为:NH4+、Cu2+;
(5)实验过程②发生的反应有硫酸铜和氢氧化钠反应产生氢氧化铜沉淀和硫酸钠,硝酸铵和氢氧化钠反应产生氨气、水和硝酸钠,化学方程式为:NH4NO3+NaOH=NH3↑+NaNO3+H2O.
故答案为:(1)BaSO4,NH3;
(2)Fe2O3;
(3)NaCl;
(4)NH4+、Cu2+;
(5)NH4NO3+NaOH=NH3↑+NaNO3+H2O.
点评 本题考查了常见物质的推断,在解此类题时,首先分析题中所给物质的性质,然后依据题中的现象确定各种物质的存在性,最后确定混合物的成分.

| A. | 苹果腐烂 | B. | 石蜡熔化 | C. | 石油分馏 | D. | 蔗糖溶解 |
| 实验内容 | 实验设计 | |
| A | 除去锌粉中少量的铁粉 | 加入足量的稀硫酸,过滤,洗涤,烘干 |
| B | 提纯含有少量KNO3的NaCl固体 | 先加入水溶解,蒸发到大量固体析出时,把剩余的少量液体倒掉,晾干即得到较纯净的NaCl |
| C | 区分NH4HCO3和NH4Cl | 取样,加稀盐酸,看是否有气泡产生 |
| D | 分离CO2和CO混合物 | 先用NaOH溶液吸收掉CO2分离出CO,再向剩余溶液中加足量稀硫酸“释放”出CO2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 澄清石灰水、二氧化碳 | B. | 河水、汽水 | ||
| C. | 液氧、稀盐酸 | D. | 水蒸气、石油 |