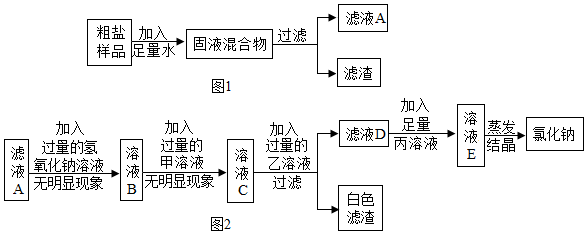
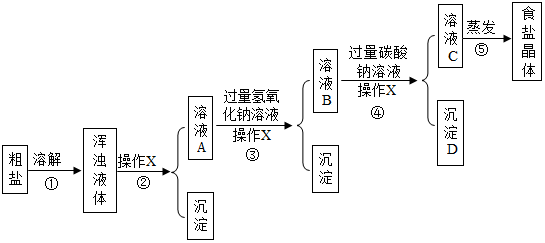
题目内容
8.海水晒盐得到的粗盐中常含有MgCl2、CaCl2等杂质,工业提纯粗盐的过程如图所示: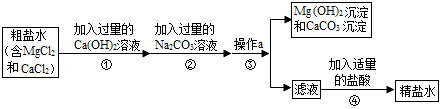
(1)步骤②反应的化学方程式为MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2或Na2CO3+CaCl2=CaCO3↓+2NaCl.(任写一个)
(2)步骤④加入适量盐酸的目的是除去滤液中的Na2CO3和NaOH.
(3)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有Ca(OH)2.
分析 (1)根据质量守恒定律正确书写化学方程式;
(2)根据盐酸在反应中的作用来解答;
(3)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有①中加入的过量的氢氧化钙未被除去.
解答 解:(1)氢氧化钙溶液和氯化镁反应生成氢氧化镁沉淀和氯化钙;碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠与过量的氢氧化钙反应生成碳酸钙沉淀和氢氧化钠;故填:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2或Na2CO3+CaCl2=CaCO3↓+2NaCl;
(2)步骤④加入适量盐酸的目的是除去滤液中的Na2CO3和氢氧化钠;故填:NaOH;
(3)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有①中加入的过量的氢氧化钙未被除去.故填:Ca(OH)2.
点评 粗盐提纯是经常考查的内容,其中要涉及到化学方程式的书写、过滤操作、杂质的除去等内容,需要同学们对此内容了然于心.

练习册系列答案
相关题目
17.不同场合制取氧气的实验原理可能不同.
【实验室制取氧气】甲组同学用以下装置收集干燥的氧气.

①写出图中仪器名称a分液漏斗 b铁架台;
②写出装置A中发生反应的化学方程式2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.实验过程中,观察到装置B中白色固体变蓝、C、D中无明显现象,写出装置B中发生反应的化学方程式CuSO4+5H2O=CuSO4•5H2O;
③装置E用于收集氧气,请在图中将导管补画完整 ;
;
④若E中氧气已集满,将带火星的木条放在导管口m处,可观察到木条复燃;
【潜水艇里制氧气】潜水艇中可用过氧化钠(Na2O2)制取氧气,反应原理是:2Na2O2+2CO2→2Na2CO3+O2.乙组同学欲用过氧化钠制取干燥的氧气.他们更改了上图装置中的一些药品后进行实验,装置内的药品如下:
⑤乙组实验:装置A中发生反应的化学方程式CaCO3+2HCl═CaCl2+H2O+CO2↑,C装置中氢氧化钠溶液的作用是除去二氧化碳,避免混入氧气中;
⑥在甲、乙两组实验中,装置D的作用是否相同?阐述理由不同.甲组:检验氧气是否已干燥;乙组:除去水蒸气.
【实验室制取氧气】甲组同学用以下装置收集干燥的氧气.

①写出图中仪器名称a分液漏斗 b铁架台;
②写出装置A中发生反应的化学方程式2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.实验过程中,观察到装置B中白色固体变蓝、C、D中无明显现象,写出装置B中发生反应的化学方程式CuSO4+5H2O=CuSO4•5H2O;
③装置E用于收集氧气,请在图中将导管补画完整
 ;
;④若E中氧气已集满,将带火星的木条放在导管口m处,可观察到木条复燃;
【潜水艇里制氧气】潜水艇中可用过氧化钠(Na2O2)制取氧气,反应原理是:2Na2O2+2CO2→2Na2CO3+O2.乙组同学欲用过氧化钠制取干燥的氧气.他们更改了上图装置中的一些药品后进行实验,装置内的药品如下:
| 乙组实验 | 装置A | 装置B | 装置C | 装置D |
| 装置内药品 | 大理石、稀盐酸 | 过氧化钠 | 氢氧化钠浓溶液 | 无水硫酸铜 |
⑥在甲、乙两组实验中,装置D的作用是否相同?阐述理由不同.甲组:检验氧气是否已干燥;乙组:除去水蒸气.