题目内容
9.下表是元素周期表中的一部分:
(1)地壳中含量仅次于氧的元素(填符号)是Si.
(2)分析上表规律可推知,表中X=16.
(3)上表元素中,由氯元素与一种金属元素组成的化合物共有五种.
(4)元素M的某化合物的化学式为MOH,它的相对分子质量为23.941,则M元素的符号是Li.
(5)A、B、C、D四种粒子的结构示意图如图:
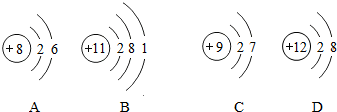
属于阳离子的是D(选填序号),它的化学符号是Mg2+.
(6)查阅资料可知:金属的活动性取决于该金属原子的电子层数和最外层电子数,电子层数越多,最外层电子数越少,该金属的活动性越强.铷元素(元素符号为Rb)的原子结构示意图为:
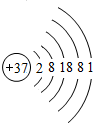
铷的金属活动比钠强(填强或弱).
分析 (1)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁;
(2)元素周期表中,随原子序数的递增;
(3)根据化合物的形成过程来分析;
(4)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答;
(5)根据当质子数=核外电子数,为原子;当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子;据此进行分析解答;
(6)铷的电子层数比钠的电子层数多,则可推金属的活动性.
解答 解:(1)地壳中含量仅次于氧元素的元素是硅元素;故填:Si;
(2)在元素周期表中,根据同一周期元素原子序数的依次递增的规律,故X介于质子数为15和17之间,为:16;
(3)在化学变化中,金属元素易失去最外层的电子而形成阳离子,可以与氯离子结合成化合物,如氯化锂、氯化铍、氯化钠、氯化镁和氯化铝共五种;故填:五;(4)元素M的某化合物的化学式为MOH,它的相对分子质量为23.941,则M元素的相对分子质量为:23.941-1-16=6.941,是锂元素,故填:Li;
(5)A.质子数=核外电子数,属于原子;B.质子数=核外电子数,属于原子C.质子数=核外电子数,属于原子D.质子数>核外电子数,属于阳离子,是镁离子;故填:D;Mg2+;
(6)因金属的活动性取决于该金属原子的电子层数和最外层电子数,电子层数越多,最外层电子数越少,该金属的活动性越强,铷的电子层数比钠的电子层数多,则铷的活动性强,故答案为:强.
点评 本题考查学生根据地壳中含量最多的元素,元素周期表中,随原子序数的递增,同一周期元素最外层电子数逐渐增多与质子数与核电荷数的关系进行分析解题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列化学用语中,正确的是( )
| A. | 硫酸钠的化学式NaSO4 | |
| B. | 四个氮原子2N2 | |
| C. | 三个碳酸根离子3CO32- | |
| D. | 硫在氧气中燃烧2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO3 |
1.下列实验现象描述不正确的是( )
| A. | 红磷燃烧:产生黄白色火焰、放热、产生大量白烟 | |
| B. | 氢气燃烧:产生淡蓝色火焰、放热 | |
| C. | 铁丝燃烧:生成黑色固体四氧化三铁、放热 | |
| D. | 硫在氧气中燃烧:产生蓝紫色火焰、生成有刺激性气味的气体、放热 |
18.实验室制二氧化碳主要过程有以下几步:①检查装置的气密性 ②按要求连接好仪器 ③向容器中注入酸液 ④向广口瓶中放入小块的大理石 ⑤收集气体.正确操作顺序为( )
| A. | ①②③④⑤ | B. | ②①④③⑤ | C. | ①④③②⑤ | D. | ②③④①⑤ |
19.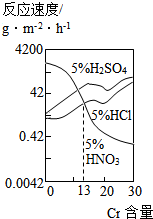 如图是三种酸对Fe-Cr合金随Cr含量变化的腐蚀性实验结果,下列说法正确的是( )
如图是三种酸对Fe-Cr合金随Cr含量变化的腐蚀性实验结果,下列说法正确的是( )
 如图是三种酸对Fe-Cr合金随Cr含量变化的腐蚀性实验结果,下列说法正确的是( )
如图是三种酸对Fe-Cr合金随Cr含量变化的腐蚀性实验结果,下列说法正确的是( )| A. | 稀硫酸对Fe-Cr合金的腐蚀性比稀硝酸和稀盐酸都强 | |
| B. | 随着Fe含量的增加,Fe-Cr合金在5%HNO3中的耐腐蚀性越来越弱 | |
| C. | Cr含量等于13%时,三种酸对Fe-Cr合金的腐蚀速率由快到慢的顺序为H2SO4>HCl>HNO3 | |
| D. | Cr含量小于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强 |