题目内容
4.把17.1g氯化钠和碳酸钠的混合物,加入100g7.3%的盐酸中,恰好完全反应.计算:(1)生成气体的质量和体积(标准状况下二氧化碳的密度为1.96g/L).
(2)反应后所得溶液中溶质的质量分数.
分析 (1)根据稀盐酸中溶质的质量结合反应的化学方程式可以计算出生成二氧化碳的质量,然后根据密度公式可以计算出二氧化碳的体积;
(2)反应所得溶液为氯化钠溶液,根据化学方程式可以计算出氯化钠的质量,然后结合溶液中溶质的质量分数的计算公式可以完成解答.
解答 解:(1)盐酸中溶质的质量为:100g×7.3%=7.3g;
设原固体混合物中碳酸钠的质量为x,生成氯化钠的质量为y,生成二氧化碳的质量为z
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
x 7.3g y z
$\frac{106}{x}$=$\frac{117}{y}$=$\frac{44}{z}$=$\frac{73}{7.3g}$
解得:x=10.6g y=11.7g z=4.4g
二氧化碳的体积为:4.4g÷1.96g/L=2.24L
(2)反应后所得溶液中溶质的质量分数为:$\frac{17.1g-10.6g+11.7g}{17.1g+100g-4.4g}$×100%=16.1%.
答:(1)生成气体的质量为4.4g,体积为2.24L;
(2)反应后所得溶液中溶质的质量分数为16.1%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
14.郴州市桂阳县千年矿都宝山矿矿藏极为丰富,有铅、锌、银、金、钼、铼、铋、铜、硫、铁等多种有色金属,其中的金属可用FeCl2溶液来比较其活动性顺序的是( )
| A. | Pb和Ag | B. | Ag和Au | C. | Cu和Zn | D. | Cu和Ag |
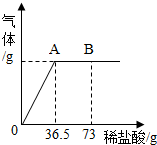 我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计).为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸.当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出).产生气体的质量与滴入稀盐酸的质量关系如图所示.试计算:
我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计).为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸.当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出).产生气体的质量与滴入稀盐酸的质量关系如图所示.试计算: 实验室欲配制1000g溶质质量分数为4%的氢氧化钠溶液.请回答下列问题;
实验室欲配制1000g溶质质量分数为4%的氢氧化钠溶液.请回答下列问题; A,B,C,D,E是常见的无色无味气体,X,Y,Z,W都是化合物,它们之间的转化关系如图所示,(图中略去部分反应产物),其中反应⑤是初中化学实验室制取气体E常用的方法.
A,B,C,D,E是常见的无色无味气体,X,Y,Z,W都是化合物,它们之间的转化关系如图所示,(图中略去部分反应产物),其中反应⑤是初中化学实验室制取气体E常用的方法.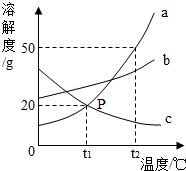 如图是a、b、c三种固体物质的溶解度曲线.
如图是a、b、c三种固体物质的溶解度曲线.