题目内容
9.按要求完成以下化学方程式:(1)电解水:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
(2)高锰酸钾制氧气2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)点燃镁条2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;
(4)属于化合反应的一个化学方程式:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
分析 (1)根据水在通电的条件下生成氢气和氧气进行分析;
(2)根据高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气进行分析;
(3)根据镁和氧气在点燃的条件下生成氧化镁进行分析;
(4)根据铁和氧气在点燃的条件下生成四氧化三铁,属于化合反应进行分析.
解答 解:(1)水在通电的条件下生成氢气和氧气,化学方程式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
(2)高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)镁和氧气在点燃的条件下生成氧化镁,化学方程式为:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;
(4)铁和氧气在点燃的条件下生成四氧化三铁,属于化合反应,化学方程式为:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
故答案为:(1)2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
(2)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;
(4)3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
点评 在解此类题时,首先分析应用的原理,然后找出反应物、生成物,最后结合方程式的书写规则书写方程式.

练习册系列答案
相关题目
20.关于CO 的叙述不正确的是( )
| A. | CO 有可燃性和还原性 | |
| B. | CO 可用排水集气法收集 | |
| C. | CO 有毒,能跟血红蛋白结合,使人体缺氧 | |
| D. | CO 可用向上排空气法收集 |
4.毕倭寇同学想通过实验,探究某企业用氨碱法生产纯碱样品的成分及含量.
【提出问题】该纯碱样品中含有哪些物质?
【猜想与假设】通过分析,毕倭寇同学做出如下假设:(1)只含有Na2CO3;(2)含有Na2CO3和 NaHCO3【查阅资料】
(1)表中的现象I为产生气泡;
(2)现象Ⅱ对应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
【实验探究】为了确定纯碱样品的成分,毕倭寇同学设计如下实验方案,请你一起完成下列实验报告.
【实验反思】实验步骤A中,氯化钙溶液过量的目的是将碳酸钠全部除去.
【提出问题2】如何测量该纯碱样品中各物质的含量?
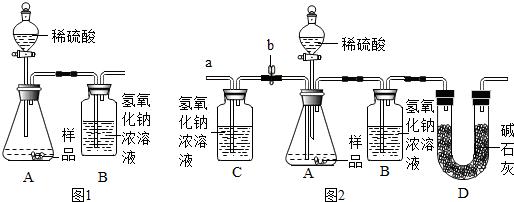
(1)为测量该纯碱样品各成分的含量,毕倭寇同学设了图1装置,通过称量B装置中质量变化来确定样品中各成分的含量.该装置气密性良好,稀硫酸与样品、进入装置B的CO2与NaOH均完全反应,操作无误,但多次实验发现,测定结果有偏差.造成偏差的原因有①空气中的CO2进入装置B被氢氧化钠吸收;②装置A中残留的CO2未被装置B中的氢氧化钠吸收.
(2)毕倭寇同学在老师的指导下重新设计了如图2所示的实验装置.该实验有以下操作步骤:
①查装置气密性,将Wg干燥的样品放入锥形瓶中;
②称量盛有氢氧化钠浓溶液的B瓶质量;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加入稀硫酸至不再产生气泡;
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量,计算样品中各成分的含量.
该实验的正确步骤是①③②④⑥⑤⑦.
【提出问题】该纯碱样品中含有哪些物质?
【猜想与假设】通过分析,毕倭寇同学做出如下假设:(1)只含有Na2CO3;(2)含有Na2CO3和 NaHCO3【查阅资料】
| NaHCO3 | Na2CO3 | |
| 加入稀盐酸 | 现象I | 产生气泡 |
| 加入饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
| 加入CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
| 加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
(2)现象Ⅱ对应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
【实验探究】为了确定纯碱样品的成分,毕倭寇同学设计如下实验方案,请你一起完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论及化学方程式 |
| A取少量样品溶于水,加入过量的CaCl2溶液 | ①有白色沉淀产生 | 该反应的方程式:②Na2CO3+CaCl2═CaCO3↓+2NaCl |
| B将上述反应后的混合液过滤,取滤液③滴加稀盐酸 | ④有气泡冒出 | 证明猜想②成立 |

【实验反思】实验步骤A中,氯化钙溶液过量的目的是将碳酸钠全部除去.
【提出问题2】如何测量该纯碱样品中各物质的含量?
(1)为测量该纯碱样品各成分的含量,毕倭寇同学设了图1装置,通过称量B装置中质量变化来确定样品中各成分的含量.该装置气密性良好,稀硫酸与样品、进入装置B的CO2与NaOH均完全反应,操作无误,但多次实验发现,测定结果有偏差.造成偏差的原因有①空气中的CO2进入装置B被氢氧化钠吸收;②装置A中残留的CO2未被装置B中的氢氧化钠吸收.
(2)毕倭寇同学在老师的指导下重新设计了如图2所示的实验装置.该实验有以下操作步骤:
①查装置气密性,将Wg干燥的样品放入锥形瓶中;
②称量盛有氢氧化钠浓溶液的B瓶质量;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加入稀硫酸至不再产生气泡;
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量,计算样品中各成分的含量.
该实验的正确步骤是①③②④⑥⑤⑦.
14.在化学反应A+B=C+D中,20克和40克B恰好完全反应生成10克C,若反应生成20克D,则参加反应的A的质量为( )
| A. | 4克 | B. | 8克 | C. | 12克 | D. | 16克 |
11.某化学兴趣小组的同学在探究酸碱的化学性质时,做了如下实验.请你一起与小组同学完成下列探究活动:
【学生实验】取一定质量的澄清石灰水,滴加稀盐酸,无明显现象.请写出反应方程式 ①Ca(OH)2+2HCl=CaCl2+2H2O.
【提出问题】反应后溶液中的溶质成分是什么?
【假设猜想】猜想Ⅰ:溶质为CaCl2; 猜想Ⅱ:CaCl2和HCl;
猜想Ⅲ:②CaCl2和Ca(OH)2; 猜想Ⅳ:CaCl2和Ca(OH)2和HCl;
某同学认为以上猜想有一个是不合理的,是猜想 ③Ⅳ(填序号)并说明原因 ④氢氧化钙和稀盐酸不能共存.
【实验探究】用上述反应后的溶液进行如下实验(填写表格中未完成的项目):
【实验结论】通过以上实验探究,得出猜想⑦Ⅱ成立.
【拓展迁移】小组同学反思了酸碱中和反应如果没有明显现象,通常在反应前的溶液中先滴加酸碱指示剂,借助指示剂颜色的变化来判断反应进行的程度.
下列中和反应需要借助指示剂来判断反应发生的是⑧BD(填字母)
A.氢氧化钡溶液和稀硫酸 B.烧碱溶液和稀硫酸
C.氢氧化铁和稀盐酸 D.氢氧化钾溶液和稀盐酸.
【学生实验】取一定质量的澄清石灰水,滴加稀盐酸,无明显现象.请写出反应方程式 ①Ca(OH)2+2HCl=CaCl2+2H2O.
【提出问题】反应后溶液中的溶质成分是什么?
【假设猜想】猜想Ⅰ:溶质为CaCl2; 猜想Ⅱ:CaCl2和HCl;
猜想Ⅲ:②CaCl2和Ca(OH)2; 猜想Ⅳ:CaCl2和Ca(OH)2和HCl;
某同学认为以上猜想有一个是不合理的,是猜想 ③Ⅳ(填序号)并说明原因 ④氢氧化钙和稀盐酸不能共存.
【实验探究】用上述反应后的溶液进行如下实验(填写表格中未完成的项目):
| 实验方案 | 方案一:加锌粒 | 方案二:滴加酚酞溶液 |
| 实验操作 |  |  |
| 实验现象 | ⑤产生气泡 | 无明显现象 |
| 实验结论 | 溶液中有HCl | 溶液中无⑥Ca(OH)2 |
【拓展迁移】小组同学反思了酸碱中和反应如果没有明显现象,通常在反应前的溶液中先滴加酸碱指示剂,借助指示剂颜色的变化来判断反应进行的程度.
下列中和反应需要借助指示剂来判断反应发生的是⑧BD(填字母)
A.氢氧化钡溶液和稀硫酸 B.烧碱溶液和稀硫酸
C.氢氧化铁和稀盐酸 D.氢氧化钾溶液和稀盐酸.
 ClO2是新一代饮用水的消毒剂,可以用来代替Cl2进行自来水的消毒.请回答下列问题:
ClO2是新一代饮用水的消毒剂,可以用来代替Cl2进行自来水的消毒.请回答下列问题: