题目内容
碱式碳酸盐广泛应用于工农业生产。
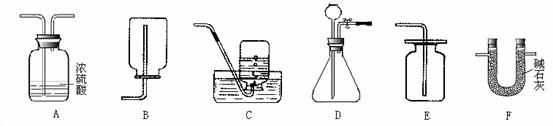
(1)某碱式碳酸盐药品M(OH)2·MCO3,为确定金属M的相对原子质量,某研究小组设计如下实验装置及步骤(不考虑植物油中溶解CO2产生的影响)。

①连接装置并_________;②准确称量样品的质量;③装药品,调节量气装置两边液面相平,读数;④加热至样品质量不再减少;⑤冷却到室温;⑥调节量气装置两边液面相平,读数、列式计算。
I.请将上述实验步骤补充完整。
II.装置B的作用是_________,少量植物油的作用是_________,C中的试剂是_________ (填字母序号)。
a.碱石灰 b.浓硫酸 c.硫酸铜
III.步骤⑥中调节液面相平的操作是将水准管_________(填“缓慢上移”或“缓慢下移”)。
IV.若其它操作均正确,仅因下列因素可使M相对原子质量的测定结果偏大的是_________ (填字母序号)。
a.反应前量气管水面在0刻度处,反应后仰视读数
b.样品未分解完全即停止实验
c.量气管中未加植物油
(2)实际生产中的碱式碳酸铜可表示为Cu(OH)2·mCuCO3,某研究小组仍使用上述装置测定m的值,测得3组数据如下表所示。取3组数据的平均值得到CO2的体积为______mL,又已知常温常压下CO2的密度为1. 964 g/L,据此计算m的值。(写出计算m的过程,最后结果保留小数点后两位)

【答案】(1)检查装置的气密性 除去水 隔离二氧化碳和水,防止二氧化碳溶于水 c 缓慢下移 bc
(2)22.40
Cu(OH)2·mCuCO3 ~ mCO2
98+124m 44m
0.21g 22.40×1. 964 g/L/1000
m=1.14
【解析】(1)反应中有气体产生,所以连接装置后要检查装置的气密性;浓硫酸具有吸水性,装置B的作用是除去碱是碳酸盐受热产生的水;二氧化碳能溶于水,少量植物油的作用是隔离二氧化碳和水;c中放置硫酸铜的目的是检验二氧化碳中混有的水蒸气是否被B装置完全吸收;反应有气体产生,水准管中的液面会高于量气管中的液面,所以应该缓慢下移;样品未分解完全即停止实验、量气管中未加植物油都会使收集到的二氧化碳气体偏少,导致M相对原子质量的测定结果偏大;(2)将二氧化碳测定的平均体积换算成质量,依据二氧化碳和Cu(OH)2·mCuCO3之间的质量关系列式计算即可。

 阅读快车系列答案
阅读快车系列答案皮蛋是一种中国传统美食。它是将鸭蛋浸入一种特制的料液中,再加工而成。根据题意回答有关问题。
【查阅资料】将纯碱,食盐加入容器中,加沸水溶解,再慢慢加入生石灰充分反应,冷却后即得到料液。
写出料液制作过程中发生反应的化学方程式 ▲ 、 ▲ 。
【提出问题】料液中除含有NaOH和NaCl外,还含有那些溶质?
【猜 想】
甲:只有Ca(OH )2,
)2,
乙:只有Na2CO3,
丙:既有Ca(OH)2,也有Na2CO3;
上述猜测中,肯定错误的是 ▲ ,其他两个还需探究。
【实验探究】
| 实验步骤 | 实验现象 | 结论 |
| ①取少量上层料液过滤,取滤液滴加足量稀盐酸 | 无明显现象 | ▲ 正确 |
| ②另取少量滤液,滴加碳酸钠溶液 | 产生白色沉淀 |
【问题与思考】
(1)生石灰加入沸水中,水能持续保持沸腾,请推测其原因是 ▲ 。
(2)实验①加入 足量稀盐酸的目的是 ▲ 。
足量稀盐酸的目的是 ▲ 。
(3)皮蛋食用时加入一些食醋,可以去除涩感,原因是 ▲ 。
糕点疏松剂的主要成分中还有碳酸氢钠,某化学兴趣小组对碳酸氢钠的化学幸会进行探究。
【探究实验一】 碳酸氢钠溶液的酸碱性:用PH试纸测得碳酸氢钠溶液的pH约为10。 由此得出的结论是碳酸氢钠溶液呈 。
【探究实验二】 碳酸氢钠能否与酸反应:取少量固体放入试管中,滴加足量的稀盐酸, 现象为 。结论:碳酸氢钠能与酸反应。
 【探究实验三】 碳酸氢钠的热稳定性:取一定量的碳酸氢钠放在 铜片上加热,如图所示。
【探究实验三】 碳酸氢钠的热稳定性:取一定量的碳酸氢钠放在 铜片上加热,如图所示。
(1) 加入一段时间后,观察到烧杯内壁有水珠。
(2) 充分加热后,将烧杯迅速倒转过来,加入适量的澄清石灰水,震荡,观察到澄清石灰水变浑浊。
(3) 通过进一步实验来确定充分加热后的固体产物的成分。限选试剂及仪器:稀盐酸、氯化钙溶液、澄清石灰水、酚酞溶液、蒸馏水、试管、胶头滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量加热后的固体产物放入试管A中,加入适量蒸馏水,充分振荡溶解,滴加足量_________,振荡,静置。 | 产生白色沉淀 | 产物含Na2CO3 |
| ② | 取操作①后的上层清液于试管B中,滴加_________。 | _________ | 产物不含NaOH |
(4)根据上述实验结论,写出碳酸氢钠受热分解的化学方程式 。
厨房中有一包无标识的白色粉末,经初步认定可能是氯化钠、碳酸钠、碳酸氢钠中的一种。小明对白色粉末的成分进行了探究。
[查阅资料]碳酸钠俗称 ▲ 、苏打,碳酸氢钠俗称小苏打,两者都属于 ▲ (选填“酸”、“碱”、“盐”),都能溶于水,且水溶液都呈碱性。
[实验探究]小明取适量白色粉末,配制成溶液,按表中所示实验方案进行探究。
| 实验步骤 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取少量溶液,滴加无色酚酞溶液 | 溶液变红色 | 白色粉末肯定不是 ▲ |
| 2 | 取少量溶液,滴加稀盐酸 | ▲ | |
| 3 | 取少量溶液,滴加澄清石灰水 | 产生白色沉淀 |
(1)请完成表中空格。
(2)实验步骤2中可能发生反应的化学方程式为 ▲ (写出一个即可)。实验步骤
3中白色沉淀的成分是 ▲ (填写化学式)。
[实验反思]小明实验后发现上述实验方案并不能确定白色粉末的组成。经老师指导后,小明再取少量配制的溶液滴加氯化钙溶液,没有观察到明显现象,则该白色粉末是 ▲ 。