题目内容
14.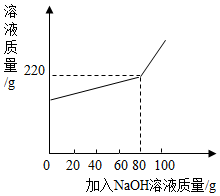 将一定量氯化镁和氯化钠的固体混合物加水配成145.8g的溶液,向所得溶液中加入一定浓度的氢氧化钠溶液,加入氢氧化钠溶液的质量与反应后溶液的质量关系如图.计算:
将一定量氯化镁和氯化钠的固体混合物加水配成145.8g的溶液,向所得溶液中加入一定浓度的氢氧化钠溶液,加入氢氧化钠溶液的质量与反应后溶液的质量关系如图.计算:(1)所用氢氧化钠溶液的溶质质量分数.
(2)恰好完全反应时所得溶液的溶质质量分数为10%,则原固体混合物的质量是多少?
分析 向所得溶液中加入一定浓度的氢氧化钠溶液时,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,加入80g氢氧化钠溶液时恰好完全反应,根据反应的化学方程式及其提供的数据可以进行相关方面的计算.
解答 解:(1)设参加反应的氢氧化钠质量为x,氯化镁质量为y,生成氯化钠质量为z,
反应生成氢氧化镁的质量为:145.8g+80g-220g=5.8g,
2NaOH+MgCl2═Mg(OH)2↓+2NaCl,
80 95 58 117
x y 5.8g z
$\frac{80}{x}$=$\frac{95}{y}$=$\frac{58}{5.8g}$=$\frac{117}{z}$,
x=8g,y=9.5g,z=11.7g,
所用氢氧化钠溶液的溶质质量分数为:$\frac{8g}{80g}$×100%=10%,
答:所用氢氧化钠溶液的溶质质量分数为10%.
(2)恰好完全反应时所得溶液的溶质质量分数为10%,则原固体混合物的质量是:220g×10%-11.7g+9.5g=19.8g,
答:恰好完全反应时所得溶液的溶质质量分数为10%,则原固体混合物的质量是19.8g.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列化学实验操作,正确的是( )
| A. |  闻气味 | B. |  称量固体 | C. |  滴加液体 | D. |  稀释浓硫酸 |
9.下列图象分别与选项中的操作相对应,其中可能合理的是( )


| A. | 电解水产生气体的变化 | |
| B. | 敞口放置于空气中的浓硫酸 | |
| C. | 等质量的镁、铝、锌分别与等质量等浓度的稀盐酸反应 | |
| D. | 用等质量等浓度的过氧化氢溶液制氧气,加MnO2的曲线是b |
 如图为a、b两种物质的溶解度曲线.请根据图中内容回答下列问题:
如图为a、b两种物质的溶解度曲线.请根据图中内容回答下列问题:

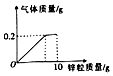 向盛有100g稀硫酸的烧杯中逐渐加入10g锌粒,产生气体质量与锌粒质量的关系如图所示.请根据关系图分析并计算:
向盛有100g稀硫酸的烧杯中逐渐加入10g锌粒,产生气体质量与锌粒质量的关系如图所示.请根据关系图分析并计算: