题目内容
7.农业上常要用质量分数为16%的氯化钠溶液选种,现配制100kg这种溶液,需氯化钠16kg,取50g该溶液稀释成质量分数为8%的氯化钠溶液,需加水的质量50g.配制时,需用到的玻璃仪器有烧杯、滴管、玻璃棒、50mL量筒.分析 利用溶质的质量=溶液质量×溶液中溶质的质量分数;根据溶液中溶质质量=溶液质量×溶液的质量分数,利用加水稀释前后溶液中溶质质量不变解答.
解答 解:100kg16%的氯化钠溶液中含溶质氯化钠的质量=100kg×16%=16kg;
取50g该溶液稀释成质量分数为8%的氯化钠溶液,设需加水质量为x,
50g×16%=(50g+x)×8%
解得x=50g,
配制时,需用到的玻璃仪器有烧杯、滴管、玻璃棒、50 mL量筒
故答案为:16;50;50 mL量筒.
点评 本题主要考查有关溶液和溶解度的计算,难度不大,把计算与实际生产相结合,体现化学的学以致用.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
17.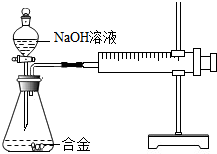 合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
【提出问题】难道NaOH溶液也能与某些金属发生化学反应吗?
【查阅资料】
(1)铝能与氢氧化钠溶液反应,铁、铜不能与氢氧化钠溶液反应.
(2)铝与氢氧化钠溶液反应的化学方程式为:2AI+2NaOH+2H2O═2NaAIO2+3H2↑
(NaAlO2溶于水,溶液显无色)
进行猜想】猜想1:该合金粉末中除铝外,还含有铁
猜想2:该合金粉末中除铝外,还含有铜
猜想3:该合金粉末中除铝外,还含有铁、铜.
实验探究】下列实验(见表1)仅供选用的试剂:20%的硫酸溶液、30%的NaOH溶液.
表1实验记录
【得出结论】猜想3成立.
【反思】
1.一般来说,活泼金属能与稀硫酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.铝与稀硫酸发生化学反应的化学方程式是2Al+3H2SO4═Al2(SO4)3+3H2↑
2.上述实验中用到的稀硫酸由浓硫酸稀释得到,稀释浓硫酸的方法是:把浓硫酸沿烧杯壁慢慢注入水中,并不断搅拌.
3.若小明向合金粉末中加入的是足量的稀硫酸,则最终剩余的固体成分是铜.
拓展与分析】为了比较铝、铁、铜的金属活动性强弱,某同学设计一个实验方案,将金属铝和铜插入到硫酸亚铁溶液中其现象是铝表面有一层红色物质出现,铜表面无现象.,说明铝、铁、铜金属活动性由弱到强顺序是铝>铁>铜.
 合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.【提出问题】难道NaOH溶液也能与某些金属发生化学反应吗?
【查阅资料】
(1)铝能与氢氧化钠溶液反应,铁、铜不能与氢氧化钠溶液反应.
(2)铝与氢氧化钠溶液反应的化学方程式为:2AI+2NaOH+2H2O═2NaAIO2+3H2↑
(NaAlO2溶于水,溶液显无色)
进行猜想】猜想1:该合金粉末中除铝外,还含有铁
猜想2:该合金粉末中除铝外,还含有铜
猜想3:该合金粉末中除铝外,还含有铁、铜.
实验探究】下列实验(见表1)仅供选用的试剂:20%的硫酸溶液、30%的NaOH溶液.
表1实验记录
| 实验步骤 | 实验现象 | 结论 |
| ①取一定量的合金粉末,加过量的30%氢氧化钠溶液,充分反应后过滤,滤渣备用 | 粉末部分溶解,并有无色气体放出 | 合金中一定含有铝 |
| ②取步骤①所得滤渣,加过量20%的硫酸溶液,充分反应 | 滤渣部分溶解,并有无色气体放出,溶液呈浅绿色 | 合金中一定含有铁、铜 |
【反思】
1.一般来说,活泼金属能与稀硫酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.铝与稀硫酸发生化学反应的化学方程式是2Al+3H2SO4═Al2(SO4)3+3H2↑
2.上述实验中用到的稀硫酸由浓硫酸稀释得到,稀释浓硫酸的方法是:把浓硫酸沿烧杯壁慢慢注入水中,并不断搅拌.
3.若小明向合金粉末中加入的是足量的稀硫酸,则最终剩余的固体成分是铜.
拓展与分析】为了比较铝、铁、铜的金属活动性强弱,某同学设计一个实验方案,将金属铝和铜插入到硫酸亚铁溶液中其现象是铝表面有一层红色物质出现,铜表面无现象.,说明铝、铁、铜金属活动性由弱到强顺序是铝>铁>铜.
18.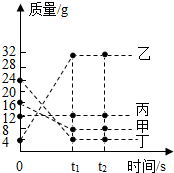 在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示.下列说法中不正确的是( )
在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示.下列说法中不正确的是( )
 在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示.下列说法中不正确的是( )
在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示.下列说法中不正确的是( )| A. | 乙物质一定是化合物 | |
| B. | 丙可能为该反应的催化剂 | |
| C. | 该反应中,乙、丁的质量变化之比为7:5 | |
| D. | 该反应中,甲、乙的质量变化之比为1:4 |
15.下列食品或调味品的制作过程中,没有新物质生成的是( )
| A. | 粮食酿白酒 | B. | 用水果榨成果汁 | ||
| C. | 牛奶变酸奶 | D. | 用小苏打焙制糕点 |
2.化学与健康息息相关.“APEC”会议的晚宴上有一道传统小吃“豌豆黄”,根据表格中的信息回答以下问题.
(1)“豌豆黄”中主要含有蛋白质、糖类和无机盐三类营养素.
(2)“豌豆黄”中含有钙元素.人体缺钙常会引起AC(填序号).
A.佝偻病 B.贫血症 C.骨质疏松 D.甲状腺肿大
(3)很多食物也能提供丰富的蛋白质.下列能提供丰富蛋白质的食品是B(填序号).

| 品名 | 豌豆黄 |
| 主要原料 | 豌豆 |
| 主要营养成分 | 蛋白质、糖类、钠、钙、钾、镁、铁等元素 |
(2)“豌豆黄”中含有钙元素.人体缺钙常会引起AC(填序号).
A.佝偻病 B.贫血症 C.骨质疏松 D.甲状腺肿大
(3)很多食物也能提供丰富的蛋白质.下列能提供丰富蛋白质的食品是B(填序号).

2.水是地球上最普通、最常见的物质之一,下列关于水的说法正确的是( )
| A. | 水是所有溶液中的溶剂 | |
| B. | 水电解生成氢气和氧气,说明化学反应中分子可以再分,原子不可再分 | |
| C. | 水的蒸发和水的电解都生成气体,它们都是化学变化 | |
| D. | 水蒸发后,水分子间的间隔增大 |
19.下列物质,不能用金属和酸反应直接制得的是( )
| A. | ZnCl2 | B. | CuCl2 | C. | FeCl2 | D. | FeSO4 |
 如图所示,A-G是初中化学常见的其中物质.→图中表示转化关系,“-”表示相互能反应,F的溶液实验室常用来检验CO2气体,D、E组成元素相同.B、C、G常温下为气体.在实验室中常用A制取G.
如图所示,A-G是初中化学常见的其中物质.→图中表示转化关系,“-”表示相互能反应,F的溶液实验室常用来检验CO2气体,D、E组成元素相同.B、C、G常温下为气体.在实验室中常用A制取G.