题目内容
6.某同学将光亮的镁条放入NaHCO3饱和溶液中,镁条消失并产生大量气泡和白色固体.为确定产生的气体和白色固体的成分,该同学进行了如下的探究.
(1)收集并点燃产生的气体,火焰呈淡蓝色,火焰上方罩涂有澄清石灰水的小烧杯,无现象,
则该气体为氢气.
(2)对白色固体做出如下猜测并进行实验:
【猜想假设】①白色固体可能是Mg(OH)2;②白色固体可能是MgCO3;③白色固体可能是Mg(OH)2和MgCO3.
【查阅资料】①:Mg(HCO3)2能溶于水; ②:MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物.
③:碱石灰主要成分是NaOH和CaO的混合物.
【进行实验】
| 操作 | 现象 | 结论 |
| 取洗净后的白色固体,加入足量的稀盐酸 | 观察到产生气泡 | 白色固体一定含有MgCO3 |
| 秤取一定量白色固体,充分加热至不再产生气体,将产生的气体先通入碱石灰,再通入浓硫酸,分别称量装置反应前后的质量 | 碱石灰增重,浓硫酸不变 | 白色固体不含有Mg(OH)2 |
分析 根据氢气燃烧产生淡蓝色的火焰进行分析;
【猜想假设】根据白色固体可能是Mg(OH)2,或MgCO3,或Mg(OH)2和MgCO3进行分析;
【进行实验】根据碳酸镁能和稀盐酸反应生成氯化镁、水和二氧化碳进行分析;
根据浓硫酸能够吸收水,碱石灰能够吸收水和二氧化碳进行分析.
解答 解:(1)收集并点燃产生的气体,火焰呈淡蓝色,火焰上方罩涂有澄清石灰水的小烧杯,无现象,则该气体为氢气;
(2)【猜想假设】通过推导可知,③白色固体可能是Mg(OH)2和MgCO3.
【进行实验】①取洗净后的白色固体,加入足量的稀盐酸,观察到产生气泡,说明白色固体一定含有MgCO3;
②秤取一定量白色固体,充分加热至不再产生气体,将产生的气体先通入碱石灰,再通入浓硫酸,分别称量装置反应前后的质量,碱石灰增重,浓硫酸不变,说明白色固体不含有Mg(OH)2.
| 操作 | 现象 | 结论 |
| 取洗净后的白色固体,加入足量的稀盐酸 | 观察到产生气泡 | 白色固体一定含有MgCO3 |
| 秤取一定量白色固体,充分加热至不再产生气体,将产生的气体先通入碱石灰,再通入浓硫酸,分别称量装置反应前后的质量 | 碱石灰增重,浓硫酸不变 | 白色固体不含有Mg(OH)2 |
改进方法是:将产生的气体先通入浓硫酸,再通入碱石灰,如果白色固体中含有氢氧化镁,则受热分解生成的水能够被浓硫酸吸收.
故答案为:(1)氢气;
(2)MgCO3 和 Mg(OH)2;
【进行实验】
| 操作 | 现象 | 结论 |
| 稀盐酸 | 产生气泡 | |
| 白色固体不含有Mg(OH)2 |
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.

练习册系列答案
相关题目
4.在实验室中,下列做法正确的是( )
| A. | 不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,再涂上3%-5%的碳酸氢钠溶液 | |
| B. | 氢氧化钠有强烈的腐蚀性,实验使用时,最好戴上防护眼镜 | |
| C. | 在实验室里不能用品尝的办法区别食盐和蔗糖晶体 | |
| D. | 配制稀硫酸时,可先在量筒中加入一定量的浓硫酸,再慢慢注入水并不断搅拌 | |
| E. | 加热试管里的液体时,试管外壁应干燥 | |
| F. | 用pH试纸测定溶液的酸碱度时,将pH试纸放入待测液中蘸取 |
17.下列有关NaOH和Ca(OH)2的说法中正确的是( )
| A. | 都易溶于水 | B. | 溶液的pH都大于7 | ||
| C. | 溶液都可检验CO2 | D. | 都能用于改良酸性土壤 |
11.研制和开发不含碳并可工业生产的清洁能源,一直是科学家不懈追求的目标,目前液氨被人们被为一种潜在的清洁燃料.
①氨气在空气中充分燃烧的产物是氮气和水,试写出氨气燃烧反应的化学方程式4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
②液氨和液氢燃料相比有关数据见表,据此判断正确的是ACD(填序号)
A.以氨和氢为燃料时,可以减缓温室效应
B.氨泄漏到空气中比氢气更易发生爆炸
C.等质量的氨和氢分别燃烧,氢放出的热量多
D.氨的液化比氢容易得多.
③在实验室中为探究氨气的性质,常用碱石灰和硫酸铵两种固体混合加热的方法制取氨气.通常情况下,氨气是一种极易溶于水,密度比空气小的气体.
请回答下列问题:
实验室制取氨气时发生装置A(填字母序号,下同)在C、D、E 三种装置中,收集氨气应选择D若用装置F 收集氨气,则应将d(填“c”或”d”)与发生装置相连接.
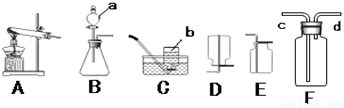
①氨气在空气中充分燃烧的产物是氮气和水,试写出氨气燃烧反应的化学方程式4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
②液氨和液氢燃料相比有关数据见表,据此判断正确的是ACD(填序号)
| 燃料 | 沸点(℃) | 燃烧放热(kJ/g) | 相对分子质量 | 爆炸极限 | 液态密度(g/cm3) |
| 氢 | -252.6 | 119.20 | 2.0 | 4.0%~75.6% | 0.07 |
| 氨 | -33.50 | 18.65 | 17.0 | 16%~25% | 0.61 |
B.氨泄漏到空气中比氢气更易发生爆炸
C.等质量的氨和氢分别燃烧,氢放出的热量多
D.氨的液化比氢容易得多.
③在实验室中为探究氨气的性质,常用碱石灰和硫酸铵两种固体混合加热的方法制取氨气.通常情况下,氨气是一种极易溶于水,密度比空气小的气体.
请回答下列问题:
实验室制取氨气时发生装置A(填字母序号,下同)在C、D、E 三种装置中,收集氨气应选择D若用装置F 收集氨气,则应将d(填“c”或”d”)与发生装置相连接.

18.下列四个成语其原意一定包含化学变化的是( )
| A. | 花香四溢 | B. | 蜡烛成灰 | C. | 木已成舟 | D. | 海市蜃楼 |