题目内容
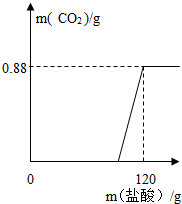 有一瓶因保存不当而部分变质的氢氧化钠固体(假设杂质只有碳酸钠),为测定其组成,称取一定质量固体样品,向其中滴加溶质质量分数为7.3%的稀盐酸,放出二氧化碳气体质量与加入稀盐酸的质量关系如右图所示.试求:
有一瓶因保存不当而部分变质的氢氧化钠固体(假设杂质只有碳酸钠),为测定其组成,称取一定质量固体样品,向其中滴加溶质质量分数为7.3%的稀盐酸,放出二氧化碳气体质量与加入稀盐酸的质量关系如右图所示.试求:(1)样品中碳酸钠的质量是多少克?它消耗的盐酸的质量是多少克?
(2)样品总质量是多少克?
(3)样品恰好完全反应时,所得溶液的溶质质量分数是多少?
分析:由生成二氧化碳的质量和稀盐酸的质量分数,根据碳酸钠与稀盐酸反应的化学方程式,可以计算出发生反应的碳酸钠的质量、稀盐酸的质量和生成氯化钠的质量.进而计算出与氢氧化钠反应的稀盐酸的质量.
由与氢氧化钠反应的稀盐酸的质量和质量分数,根据氢氧化钠与稀盐酸反应的化学方程式,可以计算出发生反应的氢氧化钠的质量和生成氯化钠的质量.进而计算出样品的总质量.
碳酸钠和氢氧化钠分别与稀盐酸反应生成氯化钠的质量和为所得溶液中溶质的质量,样品质量与稀盐酸的质量和去掉生成二氧化碳的质量就是所得溶液的质量.根据溶质质量分数的计算公式可以计算出所得溶液中溶质的质量分数.
由与氢氧化钠反应的稀盐酸的质量和质量分数,根据氢氧化钠与稀盐酸反应的化学方程式,可以计算出发生反应的氢氧化钠的质量和生成氯化钠的质量.进而计算出样品的总质量.
碳酸钠和氢氧化钠分别与稀盐酸反应生成氯化钠的质量和为所得溶液中溶质的质量,样品质量与稀盐酸的质量和去掉生成二氧化碳的质量就是所得溶液的质量.根据溶质质量分数的计算公式可以计算出所得溶液中溶质的质量分数.
解答:解:(1)设样品中碳酸钠的质量为x,与碳酸钠反应的稀盐酸的质量为y,与碳酸钠反应生成氯化钠的质量为z.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x y×7.3% z 0.88g
=
=
=
x=2.12g,y=20g,z=2.34g
(2)设样品中氢氧化钠的质量为w,与氢氧化钠反应生成氯化钠的质量为m.
NaOH+HCl=NaCl+H2O
40 36.5 58.5
w (120g-20g)×7.3% m
=
=
w=8g,m=11.7g
样品的质量为2.12g+8g=10.12g
(3)所得溶液中溶质的质量分数为
×100%≈10.9%
答:(1)样品中碳酸钠的质量为2.12g;它消耗稀盐酸的质量为20g.
(2)样品的总质量为10.12g.
(3)所得溶液中溶质的质量分数为10.9%.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x y×7.3% z 0.88g
| 106 |
| x |
| 73 |
| y×7.3% |
| 117 |
| z |
| 44 |
| 0.88g |
x=2.12g,y=20g,z=2.34g
(2)设样品中氢氧化钠的质量为w,与氢氧化钠反应生成氯化钠的质量为m.
NaOH+HCl=NaCl+H2O
40 36.5 58.5
w (120g-20g)×7.3% m
| 40 |
| w |
| 36.5 |
| (120g-20g)×7.3% |
| 58.5 |
| m |
w=8g,m=11.7g
样品的质量为2.12g+8g=10.12g
(3)所得溶液中溶质的质量分数为
| 2.34g+11.7g |
| 10.12g+120g-0.88g |
答:(1)样品中碳酸钠的质量为2.12g;它消耗稀盐酸的质量为20g.
(2)样品的总质量为10.12g.
(3)所得溶液中溶质的质量分数为10.9%.
点评:本题主要考查有关含杂质物质的化学方程式计算,难度较大.

练习册系列答案
相关题目
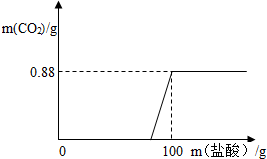 有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品,向其中滴加溶质质量分数为7.3%的稀盐酸,只放出二氧化碳气体且质量与加入稀盐酸的质量关系如右图所示.试求:
有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品,向其中滴加溶质质量分数为7.3%的稀盐酸,只放出二氧化碳气体且质量与加入稀盐酸的质量关系如右图所示.试求:
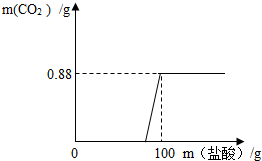 有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品配成溶液,向其中滴加溶质质量分数为7.3%的稀盐酸,只放出二氧化碳气体且质量与加入稀盐酸的质量关系如右图所示.
有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品配成溶液,向其中滴加溶质质量分数为7.3%的稀盐酸,只放出二氧化碳气体且质量与加入稀盐酸的质量关系如右图所示.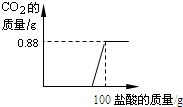 有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品配成溶液,向其中滴加溶质质量分数为7.3%的稀盐酸,结果只放出二氧化碳气体,且该气体的质量与加入稀盐酸的质量关系如图所示.试求:
有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品配成溶液,向其中滴加溶质质量分数为7.3%的稀盐酸,结果只放出二氧化碳气体,且该气体的质量与加入稀盐酸的质量关系如图所示.试求: