题目内容
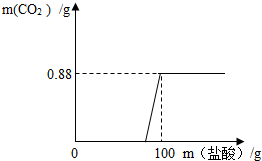 有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品配成溶液,向其中滴加溶质质量分数为7.3%的稀盐酸,只放出二氧化碳气体且质量与加入稀盐酸的质量关系如右图所示.
有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品配成溶液,向其中滴加溶质质量分数为7.3%的稀盐酸,只放出二氧化碳气体且质量与加入稀盐酸的质量关系如右图所示.试求:
(1)样品中碳酸钠的质量是多少g?
(2)样品与足量的稀盐酸反应后生成氯化钠的质量是多少g?
(3)样品中氢氧化钠的质量分数是多少?
分析:从坐标系中可以得出生成二氧化碳气体的质量为0.88g,反应一段时间之后才产生气体,说明氢氧化钠是部分变质,从而可以判断所发生的反应为氢氧化钠和盐酸、碳酸钠和盐酸这样的两个反应,解答时可以根据二氧化碳气体的质量,结合碳酸钠和稀盐酸反应的化学方程式,求算出碳酸钠的质量、生成的氯化钠的质量以及消耗盐酸的质量,然后在根据氢氧化钠和盐酸的反应求出氢氧化钠等物质的质量,可以据此解答.
解答:解:(1)设样品中碳酸钠的质量为x,碳酸钠消耗的盐酸的质量为y,同时生成氯化钠的质量为z
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
x y z 0.88g
=
=
=
解得:x=2.12g y=1.46g z=2.34g
(2)反应中一共消耗了100g盐酸,所以与氢氧化钠反应的盐酸的质量为:100g×7.3%-1.46g=5.84g
设氢氧化钠的质量为m,氢氧化钠与盐酸反应生成氯化钠的质量为n
NaOH+HCl═NaCl+H2O
40 36.5 58.5
m 5.84g n
=
=
解得:m=6.4g n=9.36g
结合(1)的解答可以知道反应中一共生成的氯化钠的质量为:2.34g+9.36g=11.7g;
(3)样品中氢氧化钠的质量分数为:
×100%=64%.
答:(1)样品中碳酸钠的质量是2.12g;
(2)样品与足量的稀盐酸反应后生成氯化钠的质量是11.7g;
(3)样品中氢氧化钠的质量分数是64%.
故答案为:(1)2.12g;
(2)11.7g;
(3)64%.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
x y z 0.88g
| 106 |
| x |
| 73 |
| y |
| 117 |
| z |
| 44 |
| 0.88g |
解得:x=2.12g y=1.46g z=2.34g
(2)反应中一共消耗了100g盐酸,所以与氢氧化钠反应的盐酸的质量为:100g×7.3%-1.46g=5.84g
设氢氧化钠的质量为m,氢氧化钠与盐酸反应生成氯化钠的质量为n
NaOH+HCl═NaCl+H2O
40 36.5 58.5
m 5.84g n
| 40 |
| m |
| 36.5 |
| 5.84g |
| 58.5 |
| n |
解得:m=6.4g n=9.36g
结合(1)的解答可以知道反应中一共生成的氯化钠的质量为:2.34g+9.36g=11.7g;
(3)样品中氢氧化钠的质量分数为:
| 6.4g |
| 10g |
答:(1)样品中碳酸钠的质量是2.12g;
(2)样品与足量的稀盐酸反应后生成氯化钠的质量是11.7g;
(3)样品中氢氧化钠的质量分数是64%.
故答案为:(1)2.12g;
(2)11.7g;
(3)64%.
点评:在解答计算题时首先要分析出所发生的反应,然后从反应中所涉及到的物质找出已知量,即可以用来计算的物质的质量,注意必须是纯净物的质量,然后解答即可.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
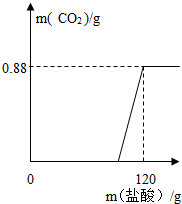 有一瓶因保存不当而部分变质的氢氧化钠固体(假设杂质只有碳酸钠),为测定其组成,称取一定质量固体样品,向其中滴加溶质质量分数为7.3%的稀盐酸,放出二氧化碳气体质量与加入稀盐酸的质量关系如右图所示.试求:
有一瓶因保存不当而部分变质的氢氧化钠固体(假设杂质只有碳酸钠),为测定其组成,称取一定质量固体样品,向其中滴加溶质质量分数为7.3%的稀盐酸,放出二氧化碳气体质量与加入稀盐酸的质量关系如右图所示.试求: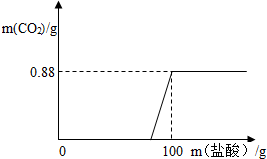 有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品,向其中滴加溶质质量分数为7.3%的稀盐酸,只放出二氧化碳气体且质量与加入稀盐酸的质量关系如右图所示.试求:
有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品,向其中滴加溶质质量分数为7.3%的稀盐酸,只放出二氧化碳气体且质量与加入稀盐酸的质量关系如右图所示.试求:
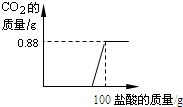 有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品配成溶液,向其中滴加溶质质量分数为7.3%的稀盐酸,结果只放出二氧化碳气体,且该气体的质量与加入稀盐酸的质量关系如图所示.试求:
有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品配成溶液,向其中滴加溶质质量分数为7.3%的稀盐酸,结果只放出二氧化碳气体,且该气体的质量与加入稀盐酸的质量关系如图所示.试求: