题目内容
2.下列装置或操作能达到实验目的是( )| A. |  收集CO2 | B. |  验证CO2性质 | ||
| C. |  比较MnO2和Fe2O3的催化效果 | D. |  测定反应产生O2的速率 |
分析 二氧化碳能够溶于水,密度比空气大;
二氧化碳能和水反应生成碳酸,碳酸能使石蕊试液变红色;
对比试验要确定好常量和变量;
过氧化氢在二氧化锰催化作用下分解生成水和氧气.
解答 解:A、因为二氧化碳密度比空气大,可以用向上排空气法收集,但是集气瓶口塞上橡皮塞后,集气瓶中的空气无法排出,无法收集二氧化碳,该选项不能达到实验目的;
B、实验过程中,石蕊试液变红色,说明二氧化碳和水反应生成了碳酸,该选项能够达到实验目的;
C、因为过氧化氢溶液的浓度不同,无法比较MnO2和Fe2O3的催化效果,该选项不能达到实验目的;
D、滴加过氧化氢溶液时,过氧化氢在二氧化锰催化作用下分解生成的氧气会从长颈漏斗逸出,无法测定产生氧气的速率,该选项不能达到实验目的.
故选:B.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
13.对比是学习化学的重要方法,下列关于H2O2与H2O的比较,错误的是( )
| A. | 两种物质都适用于在实验室中制取氧气 | |
| B. | 两种物质都属于氧化物 | |
| C. | H2O2与H2O组成元素相同,但氧元素化合价不同 | |
| D. | 一个过氧化氢分子比一个水分子多一个氧原子 |
10.金属是一种重要的材料,人类的生活和生产都离不开金属,全世界每年因生锈损失的钢铁,约占世界年产量的十分之一.
(1)用质量相等的镁粉和铝粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应,产生氢气的质量和反应所用时间的关系如图1所示.则下列说法中正确的是AB;
A.曲线a、b分别表示镁、铝的反应情况 B.盐酸均反应完,镁恰好完全反应,铝剩余
C.盐酸均反应完,镁、铝也恰好完全反应 D.镁、铝都反应完,盐酸有剩余
(2)联想到工业上用铁矿石冶炼铁,他们在实验室用CO还原氧化铁,实验如图2所示:
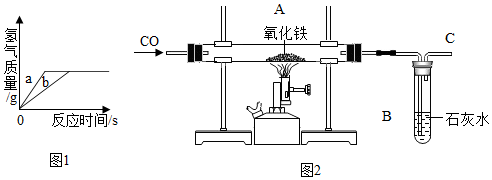
①A、B处发生的现象分别是A固体由红变黑;B石灰水变浑浊.
②为了防止溶液倒吸,本实验停止加热前是否要先断开A和B的连接处?不需要(填“需要”或“不需要”),理由是气体会一直通到装置冷却,不会发生倒吸.
(3)兴趣小组的同学又准确称取了11.5克生铁样品,放入装有100.0g稀硫酸(足量)的烧杯中(烧杯质量为55.0g).在化学反应过程中对烧杯(包括溶液和残余固体)进行了四次称量,记录如表.
求:①反应中产生氢气0.4克;
②原生铁样品中铁的质量分数.(写出计算的过程,结果精确到0.1%).
(1)用质量相等的镁粉和铝粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应,产生氢气的质量和反应所用时间的关系如图1所示.则下列说法中正确的是AB;
A.曲线a、b分别表示镁、铝的反应情况 B.盐酸均反应完,镁恰好完全反应,铝剩余
C.盐酸均反应完,镁、铝也恰好完全反应 D.镁、铝都反应完,盐酸有剩余
(2)联想到工业上用铁矿石冶炼铁,他们在实验室用CO还原氧化铁,实验如图2所示:

①A、B处发生的现象分别是A固体由红变黑;B石灰水变浑浊.
②为了防止溶液倒吸,本实验停止加热前是否要先断开A和B的连接处?不需要(填“需要”或“不需要”),理由是气体会一直通到装置冷却,不会发生倒吸.
(3)兴趣小组的同学又准确称取了11.5克生铁样品,放入装有100.0g稀硫酸(足量)的烧杯中(烧杯质量为55.0g).在化学反应过程中对烧杯(包括溶液和残余固体)进行了四次称量,记录如表.
| 反应时间 | t0 | t1 | t2 | t3 |
| 烧杯和药品的质量/g | 166.5 | 166.3 | 166.1 | 166.1 |
②原生铁样品中铁的质量分数.(写出计算的过程,结果精确到0.1%).
17.二氧化硫(SO2)可用作漂白剂、防腐剂、制硫酸,下列关于二氧化硫的说法正确的是( )
| A. | 二氧化硫含有氧分子 | |
| B. | 二氧化硫中硫元素的化合价为+2 | |
| C. | 二氧化硫属于氧化物 | |
| D. | 二氧化硫和二氧化碳的性质完全一样 |
13.属于分解反应的是( )
| A. | CuSO4+2NaOH→Na2SO4+Cu(OH)2↓ | B. | H2CO3$\stackrel{△}{→}$H2O+CO2↑ | ||
| C. | CaCO3+H2O+CO2→Ca(HCO3)2 | D. | 2Mg+CO2$\stackrel{点燃}{→}$2MgO+C |
 实验欲配制50g质量分数为5%的食盐溶液.试回答下列问题:
实验欲配制50g质量分数为5%的食盐溶液.试回答下列问题: