题目内容
小卫同学生活在农村,家里使用的是井水,烧开水的炊壶有一层很厚的水垢.查阅资料后得知:水垢的主要成分是CaCO3和Mg(OH)2,他为了弄清水垢中碳酸钙的质量分数,取经干燥后的水垢样品带到实验室用稀盐酸与其反应并进行分析.
(1)实验室的稀盐酸是用质量分数为38%的浓盐酸配制的,配制1000g质量分数为10%的稀盐酸需要该浓盐酸的质量为 g(保留一位小数).
(2)小位取10g水垢样品,与足量稀盐酸充分反应后,得到3.3g二氧化碳.该水垢中碳酸钙的质量分数为多少?
【答案】(1)263.2(2)75%
【解析】解:(1)设需要该浓盐酸的质量为x,
则有:x×38%=1000g×10%,
x=263.2g.
故填:263.2.
(2)设碳酸钙的质量为y,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
y 3.3g
 =
= ,
,
y=7.5g,
该水垢中碳酸钙的质量分数为: ×100%=75%,
×100%=75%,
答:该水垢中碳酸钙的质量分数 为75%.
为75%.

练习册系列答案
相关题目
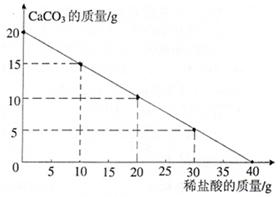
向20g CaCO3中不断地加入稀盐酸,其变化图像如右图所示。请回答以下问题:(1)当20g CaCO3完全反应时,所加稀盐酸的质量为 g。
(2)求所加稀盐酸的溶质质量分数为多少?
(写出计算过程)
对下列事实的解释,不合理的是
| 事 实 |
| |
| A | 湿衣服在阳光下比在阴凉处干得快 | 分子运动速率随温度升高而增大 |
| B | 氧气和臭氧(O3)性质不完全相同 | 构成物质的分子不同 |
| C | 水在通电条件下,可分解为氧气和氢气 | 化学反应中分子是可分的 |
| D | 金刚石和石墨的物理性质不同 | 构成物质的原子不同 |
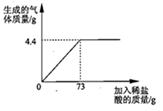 某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图
某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图 是多少?(计算结果保留一位小数,下同)
是多少?(计算结果保留一位小数,下同)

 某同学为了测定一种补钙保健食品中CaCO3的质量分数,(其包装说明如下图所示)进行了如下实验:将100片该食品研碎后放入一烧杯中,向其中慢慢滴加稀盐酸,直到不再产生气泡时,共消耗稀盐酸200g,(该保健食品中其它成分不与盐酸反应)并测得烧杯内剩余物质的总质量为232.4g.请你根据以上数据计算:
某同学为了测定一种补钙保健食品中CaCO3的质量分数,(其包装说明如下图所示)进行了如下实验:将100片该食品研碎后放入一烧杯中,向其中慢慢滴加稀盐酸,直到不再产生气泡时,共消耗稀盐酸200g,(该保健食品中其它成分不与盐酸反应)并测得烧杯内剩余物质的总质量为232.4g.请你根据以上数据计算: 解 释
解 释