题目内容
为测定铜锌合金中锌的含量,现取30g该合金样品,投入到196g某浓度的稀硫酸中,恰好完全反应,剩余的溶液和残余固体总质量为225.6g,试计算:(相对原子质量:H-1;O-16;S-32;Cu-64;Zn-65)
求:(1)产生氢气的质量为: g.
(2)该合金中锌的质量分数.
(3)剩余溶液中溶质的质量分数.(结果保留到0.1%)
求:(1)产生氢气的质量为:
(2)该合金中锌的质量分数.
(3)剩余溶液中溶质的质量分数.(结果保留到0.1%)
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)根据质量守恒定律可求出生成的氢气的质量;
(2)根据锌与硫酸反应的方程式,由氢气的质量求出锌、硫酸锌的质量,再求出该合金中锌的质量分数;
(3)根据上述计算再结合质量守恒定律及溶质质量分数的计算公式求出所得溶液中溶质的质量分数.
(2)根据锌与硫酸反应的方程式,由氢气的质量求出锌、硫酸锌的质量,再求出该合金中锌的质量分数;
(3)根据上述计算再结合质量守恒定律及溶质质量分数的计算公式求出所得溶液中溶质的质量分数.
解答:解:(1)由质量守恒定律可知生成的氢气的质量为:30g+196g-225.6g=0.4g;
(2)设参加反应的锌的质量为x,生成的硫酸锌的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.4g
=
=
解得:x=13g,y=32.2g
合金中锌的质量分数是:
×100%=43.3%;
(3)剩余溶液中溶质的质量分数是:
×100%=15.4%
故答为:(1)0.4;(2)该合金中锌的质量分数是43.3%;(3)过滤后所得溶液中溶质的质量分数是15.4%.
(2)设参加反应的锌的质量为x,生成的硫酸锌的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.4g
| 65 |
| x |
| 161 |
| y |
| 2 |
| 0.4g |
解得:x=13g,y=32.2g
合金中锌的质量分数是:
| 13g |
| 30g |
(3)剩余溶液中溶质的质量分数是:
| 32.2g |
| 13g+196g-0.4g |
故答为:(1)0.4;(2)该合金中锌的质量分数是43.3%;(3)过滤后所得溶液中溶质的质量分数是15.4%.
点评:本题难度不大,掌握根据化学方程式的计算的有关要求并结合质量守恒定律的应用即可正确解答本题.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
做空气中氧气含量测定的实验装置如图.下列有关说法正确的是( )
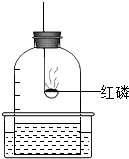

| A、选用红磷是因为反应可以耗尽O2,生成固态的P2O5 |
| B、燃烧匙中的红磷可以换成木炭 |
| C、燃烧匙中的红磷越多,水位上升越高 |
| D、本实验可以证明空气含有N2、O2、CO2和稀有气体 |
下列燃料燃烧,对环境无害的是( )
| A、酒精 | B、氢气 |
| C、汽油 | D、液化石油气 |
某同学用如图所示装置探究可燃物燃烧的条件,得到以下实验事实:
①不通空气时,冷水中的白磷不燃烧;②通空气时,冷水中的白磷不燃烧;③不通空气时,热水中的白磷不燃烧;④通空气时,热水中的白磷燃烧.能证明可燃物必须达到一定温度(着火点)才能燃烧的实验事实是( )

①不通空气时,冷水中的白磷不燃烧;②通空气时,冷水中的白磷不燃烧;③不通空气时,热水中的白磷不燃烧;④通空气时,热水中的白磷燃烧.能证明可燃物必须达到一定温度(着火点)才能燃烧的实验事实是( )

| A、②④ | B、①② | C、①④ | D、③④ |
化学方程式2H2+O2
2H2O的正确意义是( )
| ||
| A、氢气加氧气在点燃条件下等于水 |
| B、2份质量的氢气和1份质量的氧气在点燃条件下生成2份质量的水 |
| C、氢气和氧气在点燃条件下发生化学反应生成水 |
| D、氢原子和氧原子在点燃条件下生成水分子 |
下列属于物理变化的是( )
| A、食物腐败 | B、食盐溶解于水 |
| C、光合作用 | D、玉米酿酒 |