题目内容
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
【查阅资料】
资料1:该厂采用“侯氏制碱法”生产的化工产品为纯碱和氯化铵.(“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺.)
资料2:生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
资料3:部分生产流程如图所示.
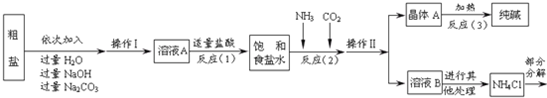
上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH═ ↓+2NaCl;
Na2CO3+CaCl2═CaCO3↓+2NaCl;NH4Cl═NH3↑+HCl↑
资料4:生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵的混合物,其反应的化学方程式为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;分离出固体产物,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为 .
【问题讨论】
(1)溶液A中的溶质为 ,操作Ⅱ的名称为 .
(2)上述生产流程中可循环使用的是 (填序号).
A.CO2 B.NH3 C.HCl D.Na2CO3
(3)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠.
【含量测定】
研究小组的同学们为了测定该纯碱样品的纯度,设计了如下实验.
甲组:
取10.0 g纯碱样品(假定杂质在整个实验过程中不发生变化),向其中加入过量的盐酸,直至样品中无气泡冒出.充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9g.样品中碳酸钠的质量分数为 (结果保留一位小数).
乙组:
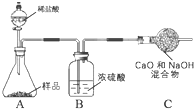
取10.0g纯碱样品,利用如图所示装置,测出反应后装置C增重了3.5g(所加试剂均足量).实验结束后,发现乙组测定的质量分数偏小,其原因是 .
【查阅资料】
资料1:该厂采用“侯氏制碱法”生产的化工产品为纯碱和氯化铵.(“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺.)
资料2:生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
资料3:部分生产流程如图所示.

上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH═
Na2CO3+CaCl2═CaCO3↓+2NaCl;NH4Cl═NH3↑+HCl↑
资料4:生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵的混合物,其反应的化学方程式为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;分离出固体产物,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为
【问题讨论】
(1)溶液A中的溶质为
(2)上述生产流程中可循环使用的是
A.CO2 B.NH3 C.HCl D.Na2CO3
(3)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠.
| 实验步骤 | 实验现象 | 实验结论 |
研究小组的同学们为了测定该纯碱样品的纯度,设计了如下实验.
甲组:
取10.0 g纯碱样品(假定杂质在整个实验过程中不发生变化),向其中加入过量的盐酸,直至样品中无气泡冒出.充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9g.样品中碳酸钠的质量分数为
乙组:
取10.0g纯碱样品,利用如图所示装置,测出反应后装置C增重了3.5g(所加试剂均足量).实验结束后,发现乙组测定的质量分数偏小,其原因是

考点:纯碱的制取,过滤的原理、方法及其应用,氯化钠与粗盐提纯,盐的化学性质,质量守恒定律及其应用,根据化学反应方程式的计算
专题:常见的盐 化学肥料
分析:[查阅资料]资料3根据化学方程式遵循质量守恒定律来推断化学式.
资料4根据信息“分离出NaHCO3,使其充分受热即可分解制得纯碱及两种常见的氧化物”书写.
【问题讨论】(1)根据粗盐的成分及它们和氢氧化钠、碳酸钠等的化学性质回答前一空;根据过滤的原理和适用范围回答后一空.
(2)根据生产流程中涉及的方程式和流程图分析回答.
(3)根据碳酸钠与碳酸氢钠不同的化学性质回答.
【含量测定】甲组:所得固体与纯碱样品的质量差实际上是生成的氯化钠与碳酸钠的质量差,据此可根据化学方程式算出样品中碳酸钠的质量,再计算其质量分数.
乙组:根据乙组测定的质量分数偏小,其直接原因是C装置增重少回答.
资料4根据信息“分离出NaHCO3,使其充分受热即可分解制得纯碱及两种常见的氧化物”书写.
【问题讨论】(1)根据粗盐的成分及它们和氢氧化钠、碳酸钠等的化学性质回答前一空;根据过滤的原理和适用范围回答后一空.
(2)根据生产流程中涉及的方程式和流程图分析回答.
(3)根据碳酸钠与碳酸氢钠不同的化学性质回答.
【含量测定】甲组:所得固体与纯碱样品的质量差实际上是生成的氯化钠与碳酸钠的质量差,据此可根据化学方程式算出样品中碳酸钠的质量,再计算其质量分数.
乙组:根据乙组测定的质量分数偏小,其直接原因是C装置增重少回答.
解答:解:[查阅资料]<资料3>有反应的化学方程式可推出化学式为Mg(OH)2.
<资料4>根据信息“分离出NaHCO3,使其充分受热即可分解制得纯碱及两种常见的氧化物”知,反应物为碳酸氢钠,条件是加热,生成物除碳酸钠外,还有两种常见的氧化物,根据碳酸氢钠的组成判断应是水和二氧化碳,故方程式为2NaHCO3
Na2CO3+H2O+CO2↑.
【问题讨论】(1)粗盐中含有少量可溶性杂质(MgCl2和CaCl2),氯化镁能与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,
氯化钙能与碳酸钠反应生成碳酸钙沉淀和氯化钠,所以A中的溶质主要是氯化钠,由于氢氧化钠和碳酸钠过量,溶液A中也有氢氧化钠和碳酸钠;过滤是把固体与液体分开的操作,操作Ⅱ将混合物分成了晶体与溶液,正是通过过滤操作.
(2)根据生产流程中涉及的方程式和流程图,发现二氧化碳、氨气、氯化氢、碳酸钠为重复使用的物质.
(3)碳酸钠化学性质稳定,碳酸氢钠受热易分解生成碳酸钠、水、二氧化碳,而二氧化碳能使澄清的石灰水变浑浊,据此可设计实验.
【含量测定】甲组:
解:设样品中碳酸钠的质量为X.
Na2CO3+2HCl=2NaCl+H2O+CO2↑ 质量差
106 117 11
X 10.9g-10.0g=0.9g
=
,
X=8.67g
样品中碳酸钠的质量分数为
×100%=86.7%
乙组:乙组测定的质量分数偏小,其直接原因是C装置增重少,可能原因是生成的二氧化碳气体没有被C中的烧碱完全吸收.
故答案为:
[查阅资料]<资料1>Mg(OH)2;
<资料3>2NaHCO3
Na2CO3+H2O+CO2↑;
【问题讨论】
(1)①NaCl、NaOH、Na2CO3;②过滤;
(2)ABCE;
(3)
【含量测定】
甲组、86.7%;乙组、生成的二氧化碳气体没有被C中的烧碱完全吸收.
<资料4>根据信息“分离出NaHCO3,使其充分受热即可分解制得纯碱及两种常见的氧化物”知,反应物为碳酸氢钠,条件是加热,生成物除碳酸钠外,还有两种常见的氧化物,根据碳酸氢钠的组成判断应是水和二氧化碳,故方程式为2NaHCO3
| ||
【问题讨论】(1)粗盐中含有少量可溶性杂质(MgCl2和CaCl2),氯化镁能与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,
氯化钙能与碳酸钠反应生成碳酸钙沉淀和氯化钠,所以A中的溶质主要是氯化钠,由于氢氧化钠和碳酸钠过量,溶液A中也有氢氧化钠和碳酸钠;过滤是把固体与液体分开的操作,操作Ⅱ将混合物分成了晶体与溶液,正是通过过滤操作.
(2)根据生产流程中涉及的方程式和流程图,发现二氧化碳、氨气、氯化氢、碳酸钠为重复使用的物质.
(3)碳酸钠化学性质稳定,碳酸氢钠受热易分解生成碳酸钠、水、二氧化碳,而二氧化碳能使澄清的石灰水变浑浊,据此可设计实验.
【含量测定】甲组:
解:设样品中碳酸钠的质量为X.
Na2CO3+2HCl=2NaCl+H2O+CO2↑ 质量差
106 117 11
X 10.9g-10.0g=0.9g
| 106 |
| 11 |
| X |
| 0.9g |
X=8.67g
样品中碳酸钠的质量分数为
| 8.67g |
| 10.0g |
乙组:乙组测定的质量分数偏小,其直接原因是C装置增重少,可能原因是生成的二氧化碳气体没有被C中的烧碱完全吸收.
故答案为:
[查阅资料]<资料1>Mg(OH)2;
<资料3>2NaHCO3
| ||
【问题讨论】
(1)①NaCl、NaOH、Na2CO3;②过滤;
(2)ABCE;
(3)
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量样品中的一种放入试管中,塞上带导管的单孔塞,导管的另一端伸入澄清的石灰水中;加热固体并观察现象. | 产生无色气泡,澄清的石灰水变浑浊 | 该样品是碳酸氢钠;另一种是碳酸钠 |
甲组、86.7%;乙组、生成的二氧化碳气体没有被C中的烧碱完全吸收.
点评:本题考查利用课本知识解决新问题能力,能加深学生对课本知识的理解,训练学生的思维能力.

练习册系列答案
相关题目
下列说法正确的是( )
| A、通常情况下水是无色的液体 |
| B、无色的液体一定是水 |
| C、只要是无色的液体,就一定能够饮用解渴 |
| D、水蒸发属于物理变化 |

 人类的生活和生产都离不开金属材料.
人类的生活和生产都离不开金属材料.