题目内容
实验室急需少量的氧化钙,临时购买不方便,某同学就用实验室现存的碳酸钙来制取.他取100g碳酸钙进行高温煅烧,但因故只加热了一段时间就停止了,后测得剩余固体中钙元素的质量分数为50%.
(1)若将100g碳酸钙全部分解可制得多少氧化钙?
(2)煅烧过程中,因碳酸钙分解向空气中排放了多少二氧化碳?
(1)若将100g碳酸钙全部分解可制得多少氧化钙?
(2)煅烧过程中,因碳酸钙分解向空气中排放了多少二氧化碳?
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:(1)碳酸钙高温下分解生成氧化钙和二氧化碳,由分解碳酸钙的质量计算出生成氧化钙的质量即可.
(2)根据化学变化前后钙元素质量不变,由反应前碳酸钙中所含钙元素的质量及反应后固体中钙元素的质量分数可计算反应后所得固体的质量,然后使用质量守恒定律,反应前后固体的质量差即为分解过程放出二氧化碳气体的质量.
(2)根据化学变化前后钙元素质量不变,由反应前碳酸钙中所含钙元素的质量及反应后固体中钙元素的质量分数可计算反应后所得固体的质量,然后使用质量守恒定律,反应前后固体的质量差即为分解过程放出二氧化碳气体的质量.
解答:解:(1)设生成氧化钙的质量为x
CaCO3
CaO+CO2↑
100 56
100g x
=
x=56g
(2)原碳酸钙100g中的钙元素质量为100g×
×100%=40g,反应前后钙元素质量不变,则剩余固体中钙元素质量仍为40g,则含钙50%的剩余固体质量=40g÷50%=80g;根据质量守恒定律,反应生成二氧化碳的质量=100g-80g=20g,.
答:(1)若100g碳酸钙全部分解可产生氧化钙56g;
(2)碳酸钙分解向空气中排放了20g二氧化碳.
CaCO3
| ||
100 56
100g x
| 100 |
| 56 |
| 100g |
| x |
(2)原碳酸钙100g中的钙元素质量为100g×
| 40 |
| 100 |
答:(1)若100g碳酸钙全部分解可产生氧化钙56g;
(2)碳酸钙分解向空气中排放了20g二氧化碳.
点评:本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列实验现象叙述正确的是( )
| A、红磷在空气中燃烧:暗红色固体燃烧,放热,生成白色固体,产生大量白色烟雾 |
| B、锌粒和稀硫酸制取氢气:银白色固体表面有气泡生成,固体逐渐减少,放热 |
| C、甲烷在空气中燃烧:无色气体燃烧,放热,产生淡蓝色火焰 |
| D、铝片放入硫酸铜溶液中:银白色固体表面有紫红色固体析出,溶液逐渐由无色变成蓝色 |
家庭厨房中现有料酒、白醋、食盐水各一瓶,区分它们最简便的方法是( )
| A、闻气味 | B、品尝味道 |
| C、取少量点燃 | D、看颜色 |
下列说法中,正确的是( )
| A、通常所说的燃烧是发光发热的现象 |
| B、可燃物与足够的氧气接触肯定会燃烧 |
| C、可燃物在纯氧中燃烧比在空气剧烈 |
| D、只有使可燃物跟空气隔绝,同时把温度降到可燃物的着火点以下才能灭火 |
下列说法你认为正确的是( )
| A、如果两种粒子属于同一种元素,则它们原子核中的质子数一定相同 |
| B、如果两种粒子含有的质子数相同,则它们一定属于同一种元素 |
| C、二氧化硫由硫,氧两个元素组成 |
| D、元素的化学性质与原子的电子数有关 |
食品与卫生健康密切相关,下列做法不会危害人体健康的是( )
| A、用甲醛溶液浸泡海产品,防止海产品变臭 |
| B、为保持肉制品鲜美,在香肠中加入过量的亚硝酸钠 |
| C、为了让猪生长的“瘦”用“瘦肉精”喂猪 |
| D、蒸馒头时加入适量的小苏打 |
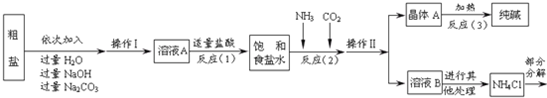
 如图,在一个透明密封的容器内,盛有一定量的红棕色溴蒸气.将活塞从A处推到B处时,看到的现象是体积
如图,在一个透明密封的容器内,盛有一定量的红棕色溴蒸气.将活塞从A处推到B处时,看到的现象是体积