题目内容
某种牙膏中的摩擦剂是碳酸钙,可以用石灰石来制备.某同学甲设计了一种制备碳酸钙的方案,其流程图为:
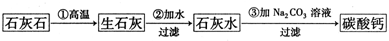
(1)请写出写出上述方案中有关反应的化学方程式
① .
② .
③ .
(2)请你仍用石灰石为原料(其它试剂自选),设计另一种制备碳酸钙的实验方案,请将你的实验方案用流程图表示出来

优点: .

(1)请写出写出上述方案中有关反应的化学方程式
①
②
③
(2)请你仍用石灰石为原料(其它试剂自选),设计另一种制备碳酸钙的实验方案,请将你的实验方案用流程图表示出来

优点:
考点:物质的相互转化和制备,碳酸钙、生石灰、熟石灰之间的转化,书写化学方程式、文字表达式、电离方程式
专题:物质的制备
分析:(1)根据碳酸钙高温分解会生成氧化钙和二氧化碳,氧化钙和水反应会生成氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠进行分析;
(2)根据碳酸钙高温分解会生成二氧化碳和氧化钙,可以将二氧化碳通入氢氧化钙中生成碳酸钙沉淀进行分析.
(2)根据碳酸钙高温分解会生成二氧化碳和氧化钙,可以将二氧化碳通入氢氧化钙中生成碳酸钙沉淀进行分析.
解答:解:(1)①碳酸钙在高温的条件下分解生成氧化钙和二氧化碳,化学方程式为:CaCO3
CaO+CO2↑;
②氧化钙和水反应会生成氢氧化钙,化学方程式为:CaO+H2O═Ca(OH)2;
③氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(2)碳酸钙高温分解会生成二氧化碳和氧化钙,可以将二氧化碳通入氢氧化钙中生成碳酸钙沉淀,所以反应流程为:

二氧化碳得到了充分的利用,所以优点是:节约原料,价廉.
故答案为:(1)CaCO3
CaO+CO2↑,CaO+H2O═Ca(OH)2,Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(2)

节约原料,价廉.
| ||
②氧化钙和水反应会生成氢氧化钙,化学方程式为:CaO+H2O═Ca(OH)2;
③氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(2)碳酸钙高温分解会生成二氧化碳和氧化钙,可以将二氧化碳通入氢氧化钙中生成碳酸钙沉淀,所以反应流程为:

二氧化碳得到了充分的利用,所以优点是:节约原料,价廉.
故答案为:(1)CaCO3
| ||
(2)

节约原料,价廉.
点评:能依据反应流程图分析发生的化学反应原理,并能书写方程式是解答此题的关键.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
下列微粒呈电中性的是( )
①分子;②原子;③质子;④原子核;⑤中子;⑥电子.
①分子;②原子;③质子;④原子核;⑤中子;⑥电子.
| A、①②③ | B、①②⑤ |
| C、③④⑤ | D、①②③⑥ |