题目内容
8.乐清是我国低压电器生产基地.在电器生产过程中,会产生含铜废料.如何从中回收铜?某科技兴趣小组提出了如下实验方案,进行了探索.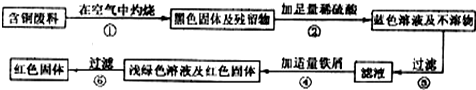
(1)实验中要进行两次过滤,下列甲、乙、丙中表示过滤操作的是甲;

(2)上述实验中发生了多个化学反应,下列化学方程式符合步骤②化学反应的是B
A.2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO
B.Cu+H2SO4═CuSO4+H2O
C.Fe+CuSO4═FeSO4+Cu
D.Fe+H2SO4+H2↑
(3)假如在实验步骤③过滤后的滤渣中,仍含有金属铜,请你写出该滤渣中可能还含有的一种金属金.
分析 根据题意可知,含铜废料在空气中灼烧时生成黑色固体为氧化铜及不与氧气反应的物质,如金等,加入足量的稀硫酸时氧化铜和稀硫酸反应生成蓝色硫酸铜溶液,再加入铁粉,铁与蓝色硫酸铜溶液反应生成浅绿色硫酸亚铁溶液及红色物质铜,再结合过滤的装置分析回答有关的问题.
解答 解:(1)过滤操作的装置:玻璃棒、漏斗、烧杯和铁架台; 故选:甲.
(2)由题意知:在步骤②中氧化铜能与稀硫酸反应生成了刘素昂同和水,反应的化学反应是:CuO+H2SO4=CuSO4+H2O,故选B.
(3)假如在实验步骤③过滤后的滤渣中,仍含有金属铜,滤渣中可能还含有的一种金属,那么该金属一定是在空气中灼烧时,不与氧气反应的物质,如金等. 故答案为:金.
点评 本题通过从废料中提取铜,考查了学生的实验能力,培养学生综合利用所学知识进行分析解题的能力.题型涉及知识面广泛,是一道锻炼能力的好题.

练习册系列答案
相关题目
19. 如图关于碳和碳的氧化物知识网络图【图中“→”表示转化关系,“…”表示相互能反应】说法正确的是( )
如图关于碳和碳的氧化物知识网络图【图中“→”表示转化关系,“…”表示相互能反应】说法正确的是( )
 如图关于碳和碳的氧化物知识网络图【图中“→”表示转化关系,“…”表示相互能反应】说法正确的是( )
如图关于碳和碳的氧化物知识网络图【图中“→”表示转化关系,“…”表示相互能反应】说法正确的是( )| A. | “C …CO2”的反应是放热反应 | |
| B. | “CO2?H2CO3”可用酚酞试剂验证 | |
| C. | “CO2→CaCO3”的反应可用于检验二氧化碳 | |
| D. | “CO→CO2”只能通过和金属氧化物反应实现 |
16.除去下列物质中的少量杂质,所选用的试剂及操作方法均正确的是( )
| 选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
| A | CO2(SO2) | 适量NaOH溶液 | 洗气 |
| B | K2SO4(KOH) | 适量HCl溶液 | 蒸发 |
| C | CO2(CO) | 足量O2 | 点燃 |
| D | FeCl2(CuCl2) | 足量铁屑 | 过滤、蒸发 |
| A. | A | B. | B | C. | C | D. | D |
20.实验室可利用碱式碳酸铜(化学式:Cu2(OH)2CO3)制备氧化铜,并进行碳粉还原氧化铜的实验.

①制备氧化铜并检验产物,装置如图1所示(省略夹持仪器):
步骤一:连接A和B,打开活塞,通入空气.
步骤二:关闭活塞,连上C和D,开始加热.
步骤三:在加热过程中,记录在B中固体质量变化如下表,在t3时停止加热.
B中发生反应的化学方程式为:Cu2(OH)2CO3═2CuO+H2O+CO2↑
A的作用是吸收空气中的水蒸气和二氧化碳,防止对产物检验造成干扰.
②一定量碳粉还原①中制得的氧化铜并检验产物,装置如图2所示:实验过程中,观察到F中溶液变浑浊,E中的现象是黑色粉末变成红色.

①制备氧化铜并检验产物,装置如图1所示(省略夹持仪器):
步骤一:连接A和B,打开活塞,通入空气.
步骤二:关闭活塞,连上C和D,开始加热.
步骤三:在加热过程中,记录在B中固体质量变化如下表,在t3时停止加热.
| 加热时间(min) | 0 | t1 | t2 | t3 |
| B中固体质量(g) | 6.66 | 5.20 | 4.80 | 4.80 |
A的作用是吸收空气中的水蒸气和二氧化碳,防止对产物检验造成干扰.
②一定量碳粉还原①中制得的氧化铜并检验产物,装置如图2所示:实验过程中,观察到F中溶液变浑浊,E中的现象是黑色粉末变成红色.

 人体内胃酸的主要成分是盐酸,胃酸过多,可引起一系列胃病.消化药片所含的物质能中和胃里过多的胃酸.某种消化药品的标记如图所示.医生给某胃酸过多的患者开出服用此药的处方为:每日三次,每次二片.试计算:患者按处方服用该药一天,理论上可中和盐酸多少毫克?
人体内胃酸的主要成分是盐酸,胃酸过多,可引起一系列胃病.消化药片所含的物质能中和胃里过多的胃酸.某种消化药品的标记如图所示.医生给某胃酸过多的患者开出服用此药的处方为:每日三次,每次二片.试计算:患者按处方服用该药一天,理论上可中和盐酸多少毫克?