题目内容
18.某化学兴趣小组欲除去固体氯化钠中混有的少量可溶性氯化镁和难溶性泥沙,设计下图所示实验方案,请参与实验并回答问题.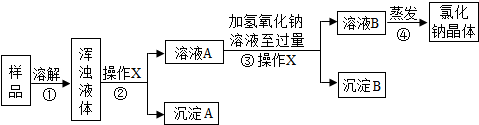
(1)步骤②、③中,操作X的名称是过滤.
(2)步骤③中,加入过量氢氧化钠溶液的目的是将杂质氯化镁完全除去;沉淀B的化学式是Mg(OH)2.
(3)步骤④蒸发操作中,当蒸发皿中出现较多固体时,停止加热.
(4)有同学认为原实验方案不完善,作出这种评价的依据是在步骤③中,加入过量的氢氧化钠溶液没有除去,导致溶液B中混有NaOH.
分析 (1)根据步骤②、③是固体与液体分离进行分析;
(2)根据氢氧化钠会与氯化镁生成氢氧化镁沉淀和氯化钠进行分析;
(3)根据蒸发操作的注意事项进行分析;
(4)根据加入的氢氧化钠溶液是过量的,因此又加入了新的杂质进行分析.
解答 解:(1)步骤②、③是固体与液体分离,所以操作X的名称是过滤;
(2)氢氧化钠会与氯化镁生成氢氧化镁沉淀和氯化钠,所以步骤③中,加入过量氢氧化钠溶液的目的是除去氯化镁杂质,沉淀B的化学式是Mg(OH)2;
(3)步骤④蒸发操作中,当蒸发皿中出现较多固体时,停止加热;
(4)方案步骤③不合理的理由是:加入的氢氧化钠溶液是过量的,则加入了新的杂质,应该采取的措施是:蒸发前,再加入适量的盐酸,调节溶液pH值.
故答案为:(1)过滤;
(2)除去氯化镁杂质,Mg(OH)2;
(3)较多固体;
(4)在步骤③中,加入过量的氢氧化钠溶液没有除去,导致溶液B中混有NaOH.
点评 本考点属于物质的分离和提纯,还考查了混合物的分离方法,是中考的重点也是一个难点.本题利用流程图中的现象和实验方案的设计,考查同学们的判断能力,同学们只要认真分析,根据条件综合把握,问题就会迎刃而解.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.化学-我们的生活,我们的未来.下列有关做法中,正确的是( )
| A. | 用霉变的花生榨取食用油 | |
| B. | 室内有煤气泄露,立即打开排气扇通风 | |
| C. | 铵态氮肥可与碱性物质混用 | |
| D. | 久未开启的地窖、窖井,不可冒然进入 |
6.2015年4月25日,尼泊尔发生8.1级强震,造成重大人员伤亡.震后灾区人民将河水净化成饮用水,河水净化的主要步骤如图所示.有关说法错误的是( )


| A. | 步骤Ⅰ可除去难溶性杂质 | B. | X可以是活性炭 | ||
| C. | 步骤Ⅲ可杀菌、消毒 | D. | 净化后的水是纯净物 |
13.形成化学观念是化学学习的任务之一.下列说法中正确的是( )
| A. | 物质在水中的溶解过程实质上是原子重新组合的过程 | |
| B. | 水的三态变化中,分子的能量、运动速率不变 | |
| C. | 分子可以再分,原子不能再分 | |
| D. | 分子由原子构成 |
3.运用推理、归纳、类比、对比的方法得出下列结论,其中合理的是( )
| A. | 铝的金属活动性比铁强,则铝制品比铁制品更容易锈蚀 | |
| B. | 水和过氧化氢的组成元素相同,则两者的化学性质相同 | |
| C. | 向某固体上滴加稀盐酸,有气泡产生,则该固体一定是碳酸盐 | |
| D. | 碱性溶液能使石蕊试液变蓝,所以能使石蕊试液变蓝的溶液呈碱性 |
10.制作糕点常用Na2CO3或NaHCO3作膨松剂,我校化学兴趣小组的同学根据Na2CO3和NaHCO3的性质进行了一系列探究.
【查阅资料】
(1)溶解度比较:
(2)已知碳酸氢钠在270℃左右就能分解为碳酸钠、水和二氧化碳,而碳酸钠受热不分解.
(3)常温下,浓度相同的Na2 CO3溶液比NaHCO3溶液的碱性强.
【探究一】NaHCO3和Na2CO溶解度差异的探究.
小方同学分别取xg两种固体粉末加入20℃10g水中充分溶解,通过观察现象区分出碳酸钠和碳酸氢钠,x可能是A.
A.2 B.0.96 C.0.5 D.3
【探究二】Na2CO3和NaHCO3鉴别探究
【猜想与假设】
(1)甲同学认为可用澄清石灰水鉴别Na2CO3和NaHCO3溶液.
(3)乙同学认为固体Na2CO3、NaHCO3可用加热的方法鉴别.
【实验探究】(1)甲同学在两支分别盛有少量Na2CO3、NaHCO3溶液的试管中,各加入澄清石灰水,观察到两支试管中的现象相同,均产生了白色沉淀,实验结果与猜想不一致,即不能用澄清石灰水鉴别Na2CO3和NaHCO3溶液.
(3)乙同学分别取了一定量的Na2CO3、NaHCO3固体于大试管中加热(如图(一)所示):①加热Na2CO3时,开始即见小试管中有少量气泡产生,继续加热,气泡逐渐减少,未见澄清石灰水变浑浊,
②加热NaHCO3时,丙同学观察到实验现象与①不同,证实了自己的猜想是合理的.
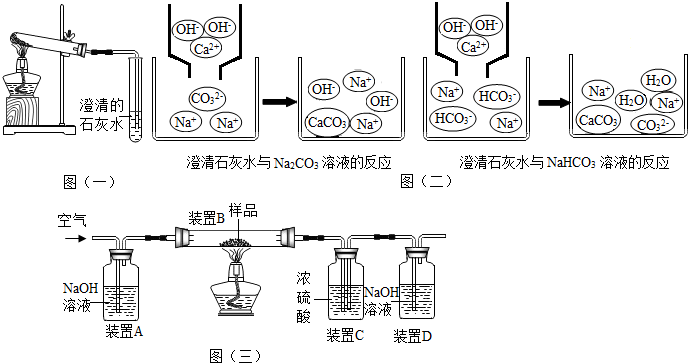
【问题讨论】
(1)小组同学对上述实验展开了讨论,对甲同学的两个实验进行了比较,并从物质在溶液中解离出不同离子的微观角度分析了原因(如图(二)1、图(二)2).请写出Na2CO3与澄清石灰水发生反应的化学方程式Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;写出NaHCO3与澄清石灰水混合时参与反应的离子:Ca2+、HC${{O}_{3}}^{-}$、OH+.
【探究三】测定某Na2CO3和NaHCO3混合物中NaHCO3的质量分数
【方案一】称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算.
(1)坩埚中发生反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(2)实验中,需加热至恒重的目的是保证NaHCO3全部分解.
【方案二】利用如图(三)装置进行实验,装置B中放有样品(整套装置气密性良好,各装置中气体吸收剂足量).
【实验步骤】
(1)检查装置的气密性;(2)称取样品10g,加到装置B中;(3)称量装置B、C、D的质量(含药品);(4)连接装置;(5)加热;(6)停止加热继续通入空气;(7)再次称量装置B、C、D的质量(含药品).【数据记录】
【问题回答】
①如图装置C的作用是吸收水蒸气,装置C中一个明显的错误是右侧导管伸入液面以下.
②实验过程中必须向装置内通入空气,装置A中发生反应的化学方程式为2NaOH+CO2=Na2CO3+H2O.若没有装置A,造成测定结果偏大(填“偏大”“不变”或“偏小”)
【讨论分析】
小红同学认为,表格中三组数据都可以计算该样品中NaHCO3的质量分数,但小张认为不能用C装置的质量变化来计算,其理由是装置A中逸出的水蒸气会进入装置C中;改进方法:在装置A、B之间增加一个浓硫酸的干燥装置.小王又认为用装置D的质量差会偏大而影响计算,应增加一个操作:连接D装置前,缓缓鼓入空气,目的是排尽装置内的二氧化碳气体.
【数据处理】经过反复讨论,大家一致赞成应该利用表格中的装置B的质量变化进行计算NaHCO3和Na2CO3混合物中NaHCO3的质量分数84%.
【拓展应用】固体Na2CO3中混有少量NaHCO3,可通过加热方法除去.
【查阅资料】
(1)溶解度比较:
| 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
(3)常温下,浓度相同的Na2 CO3溶液比NaHCO3溶液的碱性强.
【探究一】NaHCO3和Na2CO溶解度差异的探究.
小方同学分别取xg两种固体粉末加入20℃10g水中充分溶解,通过观察现象区分出碳酸钠和碳酸氢钠,x可能是A.
A.2 B.0.96 C.0.5 D.3
【探究二】Na2CO3和NaHCO3鉴别探究
【猜想与假设】
(1)甲同学认为可用澄清石灰水鉴别Na2CO3和NaHCO3溶液.
(3)乙同学认为固体Na2CO3、NaHCO3可用加热的方法鉴别.
【实验探究】(1)甲同学在两支分别盛有少量Na2CO3、NaHCO3溶液的试管中,各加入澄清石灰水,观察到两支试管中的现象相同,均产生了白色沉淀,实验结果与猜想不一致,即不能用澄清石灰水鉴别Na2CO3和NaHCO3溶液.
(3)乙同学分别取了一定量的Na2CO3、NaHCO3固体于大试管中加热(如图(一)所示):①加热Na2CO3时,开始即见小试管中有少量气泡产生,继续加热,气泡逐渐减少,未见澄清石灰水变浑浊,
②加热NaHCO3时,丙同学观察到实验现象与①不同,证实了自己的猜想是合理的.

【问题讨论】
(1)小组同学对上述实验展开了讨论,对甲同学的两个实验进行了比较,并从物质在溶液中解离出不同离子的微观角度分析了原因(如图(二)1、图(二)2).请写出Na2CO3与澄清石灰水发生反应的化学方程式Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;写出NaHCO3与澄清石灰水混合时参与反应的离子:Ca2+、HC${{O}_{3}}^{-}$、OH+.
【探究三】测定某Na2CO3和NaHCO3混合物中NaHCO3的质量分数
【方案一】称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算.
(1)坩埚中发生反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(2)实验中,需加热至恒重的目的是保证NaHCO3全部分解.
【方案二】利用如图(三)装置进行实验,装置B中放有样品(整套装置气密性良好,各装置中气体吸收剂足量).
【实验步骤】
(1)检查装置的气密性;(2)称取样品10g,加到装置B中;(3)称量装置B、C、D的质量(含药品);(4)连接装置;(5)加热;(6)停止加热继续通入空气;(7)再次称量装置B、C、D的质量(含药品).【数据记录】
| 装置B | 装置C | 装置D | |
| 实验前物质的质量/g | 180.0 | 200.0 | 122.2 |
| 实验后物质的质量/g | 176.9 | 201.5 | 124.8 |
①如图装置C的作用是吸收水蒸气,装置C中一个明显的错误是右侧导管伸入液面以下.
②实验过程中必须向装置内通入空气,装置A中发生反应的化学方程式为2NaOH+CO2=Na2CO3+H2O.若没有装置A,造成测定结果偏大(填“偏大”“不变”或“偏小”)
【讨论分析】
小红同学认为,表格中三组数据都可以计算该样品中NaHCO3的质量分数,但小张认为不能用C装置的质量变化来计算,其理由是装置A中逸出的水蒸气会进入装置C中;改进方法:在装置A、B之间增加一个浓硫酸的干燥装置.小王又认为用装置D的质量差会偏大而影响计算,应增加一个操作:连接D装置前,缓缓鼓入空气,目的是排尽装置内的二氧化碳气体.
【数据处理】经过反复讨论,大家一致赞成应该利用表格中的装置B的质量变化进行计算NaHCO3和Na2CO3混合物中NaHCO3的质量分数84%.
【拓展应用】固体Na2CO3中混有少量NaHCO3,可通过加热方法除去.
7.下列气体既能用浓H2SO4干燥,又能用NaOH干燥的气体是( )
| A. | HCl | B. | CO2 | C. | NH3 | D. | H2 |
 甲乙丙丁X都是初中化学常见的物质,它们之间的关系如图所示.(图中“-”表示两端的物质能发生化学反应,“→”表示物质间存在转化关系;部分反应物、生成物及反应条件均已略去)
甲乙丙丁X都是初中化学常见的物质,它们之间的关系如图所示.(图中“-”表示两端的物质能发生化学反应,“→”表示物质间存在转化关系;部分反应物、生成物及反应条件均已略去)