题目内容
20.某同学用如图所示装置制取气体并验证性质.
(1)实验室用装置B制取氧气,反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,若用装置E收集氧气,则气体应由b端通入(填“a”或“b”).
(2)关闭K2,打开K,通入氧气后观察到装置A中木炭燃烧得更剧烈,发出白光;由此得出氧气的化学性质是具有助燃性(支持燃烧或氧化性).
(3)关闭K2,打开K2,通入氧气,装置C、D经检验均充满氧气后,再关闭K2并撤去装置B.两天后,装置C中铁丝表面布满铁锈,装置D中不锈钢丝表面无明显现象.由此得出不锈钢丝(填“铁丝”或“不锈钢”)的抗腐蚀性较强.
(4)实验室利用装置B还可制取二氧化碳气体,写出制取该气体的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑.检验二氧化碳气体的方法是(写出操作方法、现象及结论)将气体通入澄清石灰水中,石灰水变浑浊,则为二氧化碳.
分析 (1)由题意知,反应物双氧水,生成物水和氧气,反应条件为二氧化锰做催化剂,故可书写其化学方程式;根据氧气的密度比水的小解答;
(2)根据氧气能够知识燃烧解答;
(3)根据铁丝生锈的条件解答;
(4)根据实验室用大理石和稀盐酸反应写出反应的化学方程式解答.
解答 解:(1)B是固液常温型,由题意知,反应物双氧水,生成物水和氧气,反应条件为二氧化锰,故反应的方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;氧气的密度比水的小,若用装置E收集氧气,则气体应由短管b进;
(2)关闭K2,打开K,通入氧气后观察到装置A中木炭燃烧得更剧烈,发出白光;说明氧气支持燃烧,由此得出氧气的化学性质是具有助燃性(支持燃烧或氧化性);
(3)装置C中铁丝表面布满铁锈,装置D中不锈钢丝表面无明显现象.由此得出不锈钢丝的抗腐蚀性较强;
(4)实验室用大理石和稀盐酸反应制取二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;检验二氧化碳气体的方法是:将气体通入澄清石灰水中,石灰水变浑浊,则为二氧化碳.
答案:
(1)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;b;
(2)具有助燃性(支持燃烧或氧化性);
(3)不锈钢丝;
(4)CaCO3+2HCl=CaCl2+H2O+CO2↑; 将气体通入澄清石灰水中,石灰水变浑浊,则为二氧化碳.
点评 本题是综合性较强,考查了气体制取、收集、性质、反应原理等,解决本题需要掌握氧气的反应原理、二氧化碳的实验室制法及其物理性质和化学性质、及可燃物燃烧的条件等知识.

| A. | 紫色石蕊试液 | B. | 锌粒 | C. | 碳酸钠溶液 | D. | 稀盐酸 |
 某学习小组对课本中“食盐常用于制氧气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装罝(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
某学习小组对课本中“食盐常用于制氧气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装罝(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.老师提示:I.电解饱和食盐水的化学方程式:
2NaCl+2H20$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+C12↑
II.忽略其他可能发生的反应对以下实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
| 实验步骤 | 实验现象 | 实验结论 |
| 待测液呈碱性,表明含有氢氧化钠 |
【实验】用沉淀法测定
资料摘要:氢氧化钠能与氯化镁溶液发生反应:
同学们按如图所示的实验步骤进行实验:
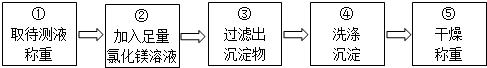
(2)步骤②加入的氯化镁溶液必须足量,其目的是使NaOH完全反应.
步骤④中判断沉淀物是否洗净的具体操作;取最后一次洗涤液少许于试管中,滴加硝酸银溶液,若无白色沉淀生成,说明沉淀物已洗净,反之则没有洗净(写出实验步骤、现象和结论).
(3)步骤②中发生反应的化学方程式是2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
(4)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影晌”).
 复分解反应是初中化学的基本反应类型之一.
复分解反应是初中化学的基本反应类型之一.