题目内容
5.下列各组中的物质充分反应后,所得溶液的质量比反应前后溶液的质量减小的是( )| A. | 氢氧化钾溶液和稀硫酸混合 | B. | 氧化铝固体粉末加入稀盐酸中 | ||
| C. | 碳酸氢钠溶液和稀盐酸混合 | D. | 二氧化硫气体通入氢氧化钠溶液中 |
分析 根据反应前后溶液组成的改变,利用反应的化学方程式或质量守恒定律,对反应后所得溶液质量进行分析,判断所得溶液的质量比反应前溶液的总质量的大小关系.
解答 解:A、氢氧化钾溶液和稀硫酸反应生成硫酸钾和水,溶液质量不变,故选项错误.
B、氧化铝粉末和盐酸反应生成氯化铝和水,反应后所得溶液为氯化铝溶液,根据质量守恒定律,所得溶液质量为盐酸的质量与固体氧化铝的质量和,所得溶液的质量比反应前溶液的总质量增加;故选项错误.
C、碳酸氢钠溶液和稀盐酸混合生成氯化钠、水和二氧化碳,由于有气体生成,因此混合后溶液的总质量减小,故选项正确.
D、二氧化硫通入氢氧化钠溶液中生成亚硫酸钠和水,反应后所得溶液为亚硫酸钠溶液,根据质量守恒定律,所得溶液质量为二氧化硫气体与氢氧化钠溶液的质量和,所得溶液的质量比反应前溶液的总质量增加;故选项错误.
故选:C.
点评 本题考查了物质间发生化学反应时溶液质量的变化,明确物质间的反应、溶解物质的质量与所析出物质的质量的差值是正确解题的关键,当析出质量大于所溶解质量时,所得溶液质量会小于反应前溶液.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目





 如图甲、乙两种微粒的结构示意图.
如图甲、乙两种微粒的结构示意图.
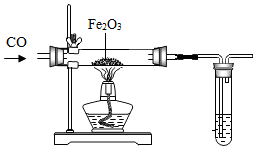 冶炼金属通常是指从矿石中提取金属单质的过程,除“沙土淘金”等物理方法外,金属冶炼大都是使金属从其化合态(化合物)转化为游离态(单质)的化学过程.根据金属的化学性质不同,工业上冶炼金属一般有以下几种方法.
冶炼金属通常是指从矿石中提取金属单质的过程,除“沙土淘金”等物理方法外,金属冶炼大都是使金属从其化合态(化合物)转化为游离态(单质)的化学过程.根据金属的化学性质不同,工业上冶炼金属一般有以下几种方法.