题目内容
20.有一包白色固体粉末,可能含有CuSO4、Na2SO4、BaCl2、NH4Cl、KCl中的一种或几种,现做如下实验:
根据上述实验现象推断下列问题.
(1)白色固体粉末中一定不含硫酸铜(填名称).
(2)写出①中发生反应的化学方程式:Na2SO4+BaCl2=BaSO4↓+2NaCl.
(3)写出②中发生反应的化学方程式:NaOH+NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$NaCl+NH3↑+H2O.
分析 根据题目给出的流程图和信息:由步骤①可知,白色固体中一定没有硫酸铜,因为硫酸铜溶于水呈蓝色;过滤得到的白色固体加入足量的盐酸不溶解,因此白色固体中一定有硫酸钡,原物质中一定有了氯化钡和硫酸钠,此白色固体是硫酸钡,说明原混合物中一定有Na2SO4、BaCl2;由步骤②可知,加入氢氧化钠溶液加热,产生了能使湿润的红色石蕊试纸变蓝的气体,此气体是氨气,因此原白色固体中一定含有氯化铵;KCl可能有也可能没有.硫酸钠和氯化钡反应生成硫酸钡白色沉淀和氯化钠,配平即可;氢氧化钠和氯化铵在加热的条件下反应生成氯化钠和水和氨气.
解答 解:(1)由步骤①可知,白色固体中一定没有硫酸铜,因为硫酸铜溶于水呈蓝色;过滤得到的白色固体加入足量的盐酸不溶解,因此白色固体中一定有硫酸钡,原物质中一定有了氯化钡和硫酸钠,此白色固体是硫酸钡,说明原混合物中一定有Na2SO4、BaCl2;由步骤②可知,加入氢氧化钠溶液加热,产生了能使湿润的红色石蕊试纸变蓝的气体,此气体是氨气,因此原白色固体中一定含有氯化铵;KCl可能有也可能没有;故答案为:硫酸铜;
(2)硫酸钠和氯化钡反应生成硫酸钡白色沉淀和氯化钠,配平即可,故答案为:Na2SO4+BaCl2=BaSO4↓+2NaCl
(3)氢氧化钠和氯化铵在加热的条件下反应生成氯化钠和水和氨气,故答案为:NaOH+NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$NaCl+NH3↑+H2O.
点评 本考点属于物质的推断题,同时也考查了化学式和化学方程式的书写等,是通过对实验方法和过程的探究,在比较鉴别的基础上,得出了正确的实验结论.本考点是中考的重要内容之一,一般有两种类型:一是图框式推断题;二是文字描述型推断题;本题属于第一种类型.不论哪一种类型,都是通过实验现象,从而得出物质的组成.此考点主要出现在填空题和实验题中.

Ⅰ.制备KClO3的流程如图1所示:

已知:①反应1为:6Cl2+6Ca(OH)2═Ca(ClO3)2+5CaCl2+6H2O.
②有关物质在常温下的溶解度如表:
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(2)反应2为复分解反应,则溶液A中含有的溶质为CaCl2和KClO3(填化学式),你认为该反应能得到KClO3晶体的原因是相同条件下,氯酸钾的溶解度最小.
(3)洗涤KClO3晶体时,可选用下列C洗涤剂(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如图2所示:已知:NH4Cl溶液呈酸性.
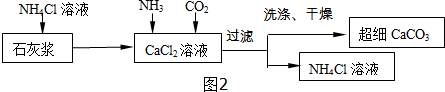
(1)向CaCl2溶液中通入两种气体,生成超细CaCO3的化学方程式CaCl2+H2O+CO2+2NH3═CaCO3↓+2NH4Cl.该流程可循环使用的物质是氯化铵溶液.
(2)检验CaCO3是否洗涤干净的方法是:取最后一次洗涤液,向其中滴加B(填写序号),观察,根据实验现象推断是否洗干净.
A.Na2CO3溶液 B.AgNO3溶液 C.酚酞试液.

资料:①不同氢氧化物沉淀的pH范围:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 8.6 |
| 完全沉淀的pH | 3.2 | 11.1 |
③高锰酸钾溶液只吸收SO2,不吸收CO2;
④碱溶液既吸收SO2,又吸收CO2.
试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为MgCO3+H2SO4=MgSO4+H2O+CO2↑.
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3,同时生成水,发生反应的化学方程式为2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2H2O.
(3)加氨水调节溶液的pH约为4的目的是,反应的化学方程式为Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓,过滤后,滤液中含有种阳离子.
(4)煅烧过程存在以下反应:
2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑
MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)

①A中现象是:玻璃管壁出现色固体;
②B中盛放的溶液可以是d(填字母),实验现象为溶液褪色;
a.Ca(OH)2溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
③C中盛放的溶液可以是氢氧化钠溶液,以吸收CO2气体,D中收集的气体是CO(填化学式).
| 物质种类 | 葡萄汗 | 苹果汁 | 牛奶 | 鸡蛋清 |
| pH | 3.5~4.5 | 2.9~3.3 | 6.3~6.6 | 7.6~8.0 |
| A. | 苹果汁和葡萄汁都显酸性 | |
| B. | 苹果汁比葡萄汁的酸性强 | |
| C. | 鸡蛋清和牛奶都显碱性 | |
| D. | 胃酸过多的人不宜多喝葡萄汁和苹果汁 |
 将一定质量的Ca(OH)2溶液与Na2CO3溶液混合恰好完全反应,向反应后的混合物中加入稀盐酸,产生气体的体积与加入稀盐酸的体积的关系如图所示,下列说法中正确的是( )
将一定质量的Ca(OH)2溶液与Na2CO3溶液混合恰好完全反应,向反应后的混合物中加入稀盐酸,产生气体的体积与加入稀盐酸的体积的关系如图所示,下列说法中正确的是( )| A. | N点时,所得溶液中的溶质只有NaCl和HCl | |
| B. | M点时,所得溶液的pH>7 | |
| C. | OP段发生反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O | |
| D. | PM段发生反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑ |
| A. |  称量氯化钠 | B. |  给固体加热 | C. |  测溶液的pH 测溶液的pH | D. |  稀释浓硫酸 |
| A. | 雨水 | B. | 蒸馏水 | C. | 海水 | D. | 消毒水 |
| A. | 分子、原子、离子都能构成物质 | |
| B. | 在化学反应过程中,原子的种类、数目均不改变 | |
| C. | 决定原子质量大小的主要是质子和电子 | |
| D. | 原子如果得到或失去电子就变成离子 |
 如图所示是被称之为“软电池”的纸质电池,采用薄层纸片作为传导体,在其一边镀锌,可作为电池负极,另一边镀二氧化锰作为电池正极.电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH).
如图所示是被称之为“软电池”的纸质电池,采用薄层纸片作为传导体,在其一边镀锌,可作为电池负极,另一边镀二氧化锰作为电池正极.电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH).