题目内容
10.实验室有如图1装置,请根据要求回答问题:
(1)写出有标号仪器的名称:①长颈漏斗;②集气瓶;
(2)实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,选用的发生装置为B(填序号);
(3)实验室用高锰酸钾制取氧气并用于验证蜡烛燃烧产物的实验,选用的收集装置为C(填序号);若用A、D装置制取氧气,当实验结束时,甲同学先移去了酒精灯,忘记将导管从水槽中取出,在水未进入试管之前,可采取的补救措施有:
①将试管口带有导管的橡皮塞取下 ②继续用酒精灯加热.
(4)常温下NO是一种无色、难溶于水的气体,密度比空气略大,在空气中能与氧气迅速反应生成红棕色的NO2气体.请你利用图2仪器I、II,设计收集一瓶较纯净的NO的操作方法:向装置I中装满水,将导管b与c用胶皮管相连,由a端通入一氧化氮气体,用排水法收集.
(5)取53.2g高锰酸钾,加热一段时间后停止,共收集到3.2g氧气.计算:
①参加反应的高锰酸钾的质量.
②剩余固体中氧元素的质量分数为36.7%.(此空直接填写结果,保留到0.1%)
分析 (1)根据实验室常用仪器的名称和题中所指仪器的作用进行分析;
(2)根据过氧化氢在二氧化锰的催化作用生成水和氧气,该反应的反应物是固体和液体,反应条件是常温进行分析;
(3)根据验证蜡烛燃烧产物的实验需要用干燥的氧气,以及实验室制取氧气的正确操作进行分析;
(4)根据NO是难溶于水的气体,密度比空气略大,在空气中能与氧气迅速反应生成红棕色的NO2气体进行分析;
(5)根据高锰酸钾受热分解的方程式,由氧气的质量可求出参加反应的高锰酸钾的质量;根据元素质量守恒,先求出53.2g高锰酸钾中总的氧元素的质量,再减去生成的氧气的质量,得到剩余固体中氧元素的质量,再除以剩余混合物的质量即可.
解答 解:(1)通过分析题中所指仪器的作用可知,①是长颈漏斗,②是集气瓶;
(2)过氧化氢在二氧化锰的催化作用生成水和氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应的反应物是固体和液体,反应条件是常温,所以选用的发生装置为B;
(3)验证蜡烛燃烧产物的实验需要用干燥的氧气,所以选用的收集装置为C,若用A、D装置制取氧气,当实验结束时,甲同学先移去了酒精灯,忘记将导管从水槽中取出,在水未进入试管之前,可采取的补救措施有:将试管口带有导管的橡皮塞取下,继续用酒精灯加热;
(4)NO是难溶于水的气体,密度比空气略大,在空气中能与氧气迅速反应生成红棕色的NO2气体,所以收集一瓶较纯净的NO的操作方法是:向装置I中装满水,将导管b与c用胶皮管相连,由a端通入一氧化氮气体,用排水法收集;
(5)解:设参加反应的高锰酸钾的质量为x
2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑
316 32
x 3.2g
$\frac{316}{x}$=$\frac{32}{3.2g}$
x=31.6g
答:参加反应的高锰酸钾的质量是31.6g;
剩余固体中氧元素的质量为:53.2g×$\frac{64}{158}$-3.2g=18.35g
因此剩余固体中氧元素的质量分数为:$\frac{18.35g}{53.2g-3.2g}$×100%=36.7%.
故答案为(1)长颈漏斗,集气瓶;
(2)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,B;
(3)C,将试管口带有导管的橡皮塞取下,继续用酒精灯加热;
(4)向装置I中装满水,将导管b与c用胶皮管相连,由a端通入一氧化氮气体,用排水法收集;
(5)①31.6g;
②36.7%.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案| A. | 1:2 | B. | 2:1 | C. | 1:5 | D. | 5:1 |
| A. | 关注食品安全,提高生活质量 | B. | 保护臭氧层,呵护我们的家园 | ||
| C. | 制造新型材料,丰富多彩世界 | D. | 诵读中华经典,放飞中国梦想 |
| A. | 该气体一定是CO、CO2的混合气体 | B. | 该气体中可能含有三种物质 | ||
| C. | 该气体中一定含有CO气体 | D. | 该气体中不可能混有氧气 |

 如图是某同学用来除去水中难溶性杂质时所采用的过滤操作图,试回答:
如图是某同学用来除去水中难溶性杂质时所采用的过滤操作图,试回答: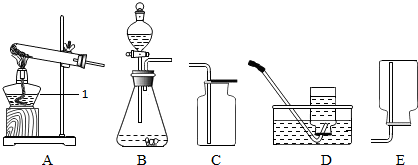

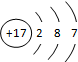 ,请写出离子符号Cl-,该元素的原子核外有3个电子层,它属于非金属 元素(填“金属”、“非金属”),其化学性质比较活泼,在化学反应中易得到(填“得到”、“失去”)电子.
,请写出离子符号Cl-,该元素的原子核外有3个电子层,它属于非金属 元素(填“金属”、“非金属”),其化学性质比较活泼,在化学反应中易得到(填“得到”、“失去”)电子.