题目内容
5.日用牙膏中常用轻质碳酸钙粉末作摩擦剂.工业大理石所含的杂质主要是氧化铁和少量难溶性物质.以这种工业大理石为原料提纯碳酸钙的流程如图.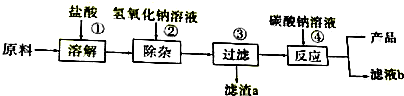
回答下列问题:
(1)为加快步骤①中的固体原料溶解,可采取的措施有搅拌(只写一点).溶解固体原料时使用盐酸,写出溶解原料过程的化学反应方程式:CaCO3+2HCl═CaCl2+H2O+CO2↑;6HCl+Fe2O3═2FeCl3+3H2O.若选用稀硫酸会生成微溶性硫酸钙,则造成的后果是反应中途停止;
(2)步骤②加入适量的氢氧化钠溶液,氢氧化钠是一种常见的碱,俗名叫火碱或烧碱或苛性钠(只写一个).除杂过程中所得到的滤渣a为氢氧化铁,过滤时用的玻璃棒的作用是引流;
(3)步骤④加入过量的碳酸钙溶液,若将滤液b中的溶质回收再用,为了得到纯净的NaCl,先加入适量的稀盐酸,其目的是除去过量的碳酸钠,再用结晶方法;
(4)产品碳酸钙在生活、生产中有广泛的用途,列举另一种实例:做补钙剂.
分析 (1)搅拌可以加快物质的溶解速率,碳酸钙和氧化铁能与稀盐酸反应;(2)根据氢氧化钠的俗称和过滤操作来分析;(4)碳酸钠能与稀盐酸发生化学反应;(5)根据碳酸钙的主要用途来分析.
解答 解:(1)搅拌可以加快固体的溶解速率,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,氧化铁能与稀盐酸反应生成氯化铁和水,硫酸钙是一种微溶于水的物质,会附着在原料固体的表面而阻止反应的发生;故填:搅拌;CaCO3+2HCl═CaCl2+H2O+CO2↑;6HCl+Fe2O3═2FeCl3+3H2O;反应中途停止;
(2)氢氧化钠俗称火碱、烧碱、苛性钠;在过滤操作中,玻璃棒的作用是引流;故填:火碱或烧碱或苛性钠;引流;
(3)因为步骤④加入过量的碳酸钠溶液,加入适量的稀盐酸是为了除去过量的碳酸钠,故填:除去过量的碳酸钠;
(4)碳酸钙中含有钙元素,能与胃酸中的稀盐酸反应生成可被人体吸收的氯化钙,所以可做补钙剂;故填:做补钙剂.
点评 熟练掌握常见物质的化学性质,解答时要仔细分析生产流程图,明确流程图中各操作在生产过程中的作用,整体把握生产过程,这是解答所提出的问题的基础.

练习册系列答案
相关题目
16.下列物质俗称、名称、化学式相符合的一组是( )
| A. | 纯碱 火碱 Na2CO3 | B. | 熟石灰 氧化钙 CaO | ||
| C. | 生石灰 碳酸钙 CaCO3 | D. | 火碱 氢氧化钠 NaOH |
10.下列实验现象描述正确的是( )
| A. | 浸透水的棉花球遇火即燃 | |
| B. | 硫酸钠和氯化钡溶液混合产生白色沉淀 | |
| C. | 加热高锰酸钾生成氧气 | |
| D. | 红磷燃烧产生大量白雾 |
4.下列说法中有错误的是( )
| A. | 过滤操作可以除去水中的不溶物 | B. | 蒸馏水是净化程度较高的水 | ||
| C. | 锅炉用水硬度太高十分危险 | D. | 市售瓶装纯净水绝不含任何杂质 |