题目内容
100克某浓度的硫酸恰好与13克的锌完全起反应。请计算:
⑴生成氢气的质量(结果精确到0.1g);
⑵将⑴的结果标在图中;
⑶反应后所得溶液中溶质的质量分数(写出计算过程,结果精确到0.1%).
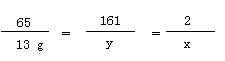
【答案】解:设生成氢气的质量为x,生成硫酸锌的质量为y。
Zn + H2SO4 = ZnSO4 + H2↑ ……………………(1分)
65 161 2
13g y x ……………………(1分)
x = 0.4 g ………………………(1分)
y = 32. 2 g ………………………(1 分)
分)

硫酸锌的质量分数 = ×100%
= 28.6% ………………………(1分)
 |
…………………(1分)
答:生成0.4克的氢气,同时硫酸锌溶液的质量分数为28.6%。
【解析】由完全反应的金属锌的质量可以求出生成的氢气和反应后所得溶液中溶质质量,溶液质量为加入的两种物质减去生成的气体(逸出),即100g + 13g -0.4g。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案铜镁合金常用作飞机天线等导电材料。欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金10g放入烧杯,将200g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下。请计算:
| 次 数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/g | 50 | 50 | 50 | 50 |
| 剩余固体质量/g | 8.5 | 7 | 6.6 | 6.6 |
(1)铜镁合金中铜的质量。
(2)求所加稀硫酸中溶质的质量分数。(写出计算过程)
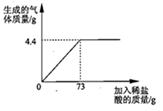 某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图
某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图 是多少?(计算结果保留一位小数,下同)
是多少?(计算结果保留一位小数,下同)
 某同学为了测定一种补钙保健食品中CaCO3的质量分数,(其包装说明如下图所示)进行了如下实验:将100片该食品研碎后放入一烧杯中,向其中慢慢滴加稀盐酸,直到不再产生气泡时,共消耗稀盐酸200g,(该保健食品中其它成分不与盐酸反应)并测得烧杯内剩余物质的总质量为232.4g.请你根据以上数据计算:
某同学为了测定一种补钙保健食品中CaCO3的质量分数,(其包装说明如下图所示)进行了如下实验:将100片该食品研碎后放入一烧杯中,向其中慢慢滴加稀盐酸,直到不再产生气泡时,共消耗稀盐酸200g,(该保健食品中其它成分不与盐酸反应)并测得烧杯内剩余物质的总质量为232.4g.请你根据以上数据计算: