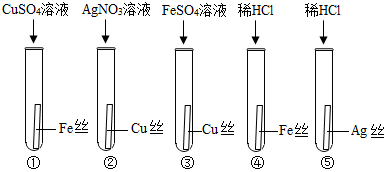
题目内容
4.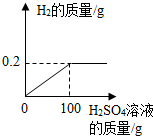 取Cu-Zn合金10g,将该合金放入烧杯中,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与产生气体的质量关系如图所示.请计算:
取Cu-Zn合金10g,将该合金放入烧杯中,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与产生气体的质量关系如图所示.请计算:(1)反应产生氢气的总质量为0.2g.
(2)计算合金中铜的质量.
(3)计算稀硫酸的溶质质量分数.
分析 根据生成的氢气的质量和对应的化学方程式求算反应的锌的质量和硫酸的质量,进而求算稀硫酸的溶质的质量分数.
解答 解:根据图可以看出生成的氢气的质量为0.2g
设参加反应的锌的质量为x,所消耗的硫酸中的溶质的质量为y.
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y 0.2g
$\frac{65}{x}$=$\frac{98}{y}$=$\frac{2}{0.2g}$
x=6.5g
y=9.8g
则合金中铜的质量为10g-6.5g=3.5g
稀硫酸的溶质质量分数为$\frac{9.8g}{100g}$×100%=9.8%
答:(1)反应产生氢气的总质量为 0.2g.
(2)合金中铜的质量为3.5g.
(3)稀硫酸的溶质质量分数为9.8%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
相关题目
15.下列反应中不属于化合反应的是( )
| A. | 镁+氧气$\stackrel{点燃}{→}$氧化镁 | B. | 红磷+氧气$\stackrel{点燃}{→}$五氧化二磷 | ||
| C. | 二氧化碳+水→碳酸 | D. | 蜡烛+氧气$\stackrel{点燃}{→}$二氧化碳+水 |
19.氯化钠在20℃时溶解度为36g,该温度下,氯化钠溶液的溶质质量分数不可能是( )
| A. | 20% | B. | 25% | C. | 26.5% | D. | 36% |
9.下列各组变化中,属于化学变化的是( )
| A. | 活性炭净水 | B. | 工业制二氧化碳 | C. | 干冰升华 | D. | 工业制氧气 |
16.如图食物中糖类含量最高的是( )
| A. |  肥肉 | B. |  山芋 | C. |  青椒 | D. |  鸡蛋 |
14.下列各组物质中,前者为化合物,中间为单质,后者为混合物的是( )
| A. | 甲烷、空气、天然气 | B. | 澄清的石灰水、水银、精盐 | ||
| C. | 硫酸铜、胆矾、铜 | D. | 氯化钙、液态氧、纯盐酸 |