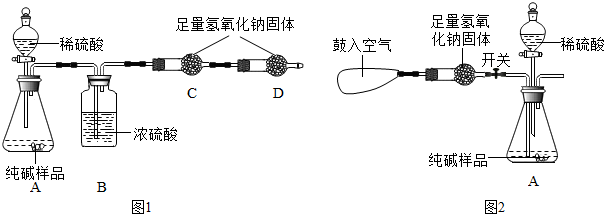
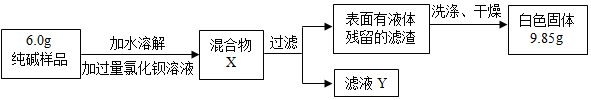
题目内容
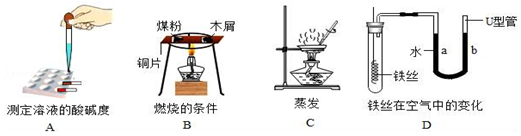
19.下列实验设计合理的是( )| A. |  除去CO中的CO2 | |
| B. | 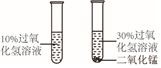 探究MnO2能否加快过氧化氢的分解速率 | |
| C. |  蜡烛燃烧验证质量守恒定律 | |
| D. |  将浑浊的地下水变成蒸馏水 |
分析 A、根据氢氧化钠溶液能吸收二氧化碳,浓硫酸具有吸水性,进行分析判断.
B、探究MnO2能否加快过氧化氢的分解速率,应控制其它变量相同,进行分析判断.
C、根据蜡烛燃烧生成二氧化碳和水蒸气,进行分析判断.
D、根据图中装置能除去难溶性杂质和一些可溶性杂质,进行分析判断.
解答 解:A、氢氧化钠溶液能吸收二氧化碳,浓硫酸具有吸水性,要注意除水蒸气要放在最后去除,否则会引入水蒸气,故选项实验设计合理.
B、探究MnO2能否加快过氧化氢的分解速率,应控制其它变量相同,图中过氧化氢溶液的溶质质量分数不同,无法确定影响的因素,故选项实验设计不合理.
C、蜡烛燃烧生成二氧化碳和水蒸气,反应后二氧化碳和水蒸气逸出,不能验证质量守恒定律,故选项实验设计不合理.
D、图中装置能除去难溶性杂质和一些可溶性杂质,不能除去水中的可溶性钙镁化合物,不能将浑浊的地下水变成蒸馏水,故选项实验设计不合理.
故选:A.
点评 本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体解题时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.X、Y两金属都能跟硝酸银溶液起反应,置换出银;X跟稀硫酸不反应,Y跟稀硫酸起反应生成氢气.由此判断X、Y两金属可能依次是( )
| A. | Fe Hg | B. | Fe Zn | C. | Cu Hg | D. | Cu Zn |
14.学习化学过程中需要经常做实验.如图所示实验操作正确的是( )
| A. |  闻气味 | B. |  倾倒液体 | C. |  取粉末 | D. |  过滤 |
8.分子、原子、离子都是构成物质的微粒,下列物质由阴、阳离子构成的是( )
| A. | 干冰 | B. | 黄金 | C. | 金刚石 | D. | 氢氧化钠 |
9. 被称之为“软电池”的纸质电池,采用薄层纸片作为传导体,电池总反应为:Zn+2MnO2+H2O═ZnO+2MnO(OH),避免了传统电池所带来的污染问题,因而废旧的纸质电池可作为一般的废弃物加以处理.下列说法正确的是( )
被称之为“软电池”的纸质电池,采用薄层纸片作为传导体,电池总反应为:Zn+2MnO2+H2O═ZnO+2MnO(OH),避免了传统电池所带来的污染问题,因而废旧的纸质电池可作为一般的废弃物加以处理.下列说法正确的是( )
 被称之为“软电池”的纸质电池,采用薄层纸片作为传导体,电池总反应为:Zn+2MnO2+H2O═ZnO+2MnO(OH),避免了传统电池所带来的污染问题,因而废旧的纸质电池可作为一般的废弃物加以处理.下列说法正确的是( )
被称之为“软电池”的纸质电池,采用薄层纸片作为传导体,电池总反应为:Zn+2MnO2+H2O═ZnO+2MnO(OH),避免了传统电池所带来的污染问题,因而废旧的纸质电池可作为一般的废弃物加以处理.下列说法正确的是( )| A. | 该电池反应中锌得到电子,元素化合价升高 | |
| B. | MnO(OH)是一种新型的氧化物 | |
| C. | 其工作原理是将化学能转化为电能 | |
| D. | 传统电池和旧的纸质电池都可以进行深埋处理 |

 实验室有一瓶久置的氢氧化钠固体,小红同学想探究一下该固体的成分.她首先查阅资料.得知:
实验室有一瓶久置的氢氧化钠固体,小红同学想探究一下该固体的成分.她首先查阅资料.得知: