题目内容
4. 实验室有一瓶久置的氢氧化钠固体,小红同学想探究一下该固体的成分.她首先查阅资料.得知:
实验室有一瓶久置的氢氧化钠固体,小红同学想探究一下该固体的成分.她首先查阅资料.得知:①CaCl2+Na2CO3=2NaCl+CaCO3↓
②CaCl2溶液呈中性.
③若有微溶物质生成.不按沉淀处理.
然后小红做了如下实验:
(1)取少量样品于试管中.加水溶解.然后滴加酚酞溶液.溶液变红.则样品中一定含有氢氧化钠.该结论不正确的原因是碳酸钠溶液显碱性,能使酚酞试液变红色
(2)取少量样品.加人稀盐酸.有气体生成.则样品中一定含有碳酸钠
(3)为证明该样品中是否还有氢氧化钠.小红又设计了如下的实验方案.请你帮助完成.
分析 氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水,碳酸钠溶液和氢氧化钠溶液都是显碱性的溶液,都能够使酚酞试液变红色;
碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,氢氧化钠和稀盐酸反应生成氯化钠和水.
解答 解:(1)取少量样品于试管中,加水溶解,然后滴加酚酞溶液,溶液变红,则样品中不一定含有氢氧化钠,这是因为氢氧化钠和二氧化碳反应生成的碳酸钠溶液显碱性,也能使酚酞试液变红色.
故填:碳酸钠溶液显碱性,能使酚酞试液变红色.
(2)取少量样品,加人稀盐酸有气体生成,则样品中一定含有碳酸钠,生成的气体是碳酸钠和盐酸反应生成的二氧化碳.
故填:碳酸钠.
(3)为证明该样品中是否还有氢氧化钠,实验方案如下所示:
实验步骤:取少量样品于试管中,加水溶解,加入足量的氯化钙溶液,过滤,向滤液中滴加适量的酚酞试液;
实验现象及其实验结论:产生白色沉淀,酚酞试液变红色,样品中有氢氧化钠(或产生白色沉淀,酚酞试液不变色,样品中没有氢氧化钠).
故答案为:实验步骤:取少量样品于试管中,加水溶解,加入足量的氯化钙溶液,过滤,向滤液中滴加适量的酚酞试液;
实验现象及其实验结论:产生白色沉淀,酚酞试液变红色,样品中有氢氧化钠(或产生白色沉淀,酚酞试液不变色,样品中没有氢氧化钠).
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
14.除去下列物质中的杂质,所选用的试剂或操作方法有错误的是( )
| 选项 | 物质 | 杂质(少量) | 试 剂 | 操作方法 |
| A | N2 | O2 | 铜网 | 将混合气体缓缓通过灼热的铜网 |
| B | KCl | K2CO3 | 盐酸 | 加入过量的盐酸、蒸发 |
| C | KNO3 | NaCl | 水 | 溶解、过滤、结晶 |
| D | MnO2 | K2MnO4 | 足量的水 | 溶解、过滤、蒸发 |
| A. | A | B. | B | C. | C | D. | D |
12.A,B两物质的溶解度曲线如图所示.下列说法错误的是( )


| A. | A物质的溶解度随温度的升高而增大 | |
| B. | t1℃时,A和B的溶解度都是50g | |
| C. | t2℃时,A溶液的溶质质量分数为50% | |
| D. | A中混有少量B时,可采用降温结晶的方法来提纯 |
19.下列实验设计合理的是( )
| A. |  除去CO中的CO2 | |
| B. | 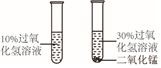 探究MnO2能否加快过氧化氢的分解速率 | |
| C. |  蜡烛燃烧验证质量守恒定律 | |
| D. |  将浑浊的地下水变成蒸馏水 |
13.使用下列各组试剂,能一次性验证Fe、Cu、Ag三中金属活动性顺序的是( )
| A. | Ag、FeSO4溶液、CuSO4溶液 | B. | Fe、Cu、AgNO3溶液 | ||
| C. | Fe、Ag、CuSO4溶液 | D. | Fe、CuSO4溶液、AgNO3溶液 |
 硝酸钾与氯化钾的溶解度曲线如图所示,回答下列问题:
硝酸钾与氯化钾的溶解度曲线如图所示,回答下列问题:
 资料显示,在煤中加入适量石灰石粉可使煤(含S)燃料时产生的SO2转化成钙盐,从而减少SO2排放,该方法被称为钙基固硫,某实验小组利用下列实验装置和药品对其可行性进行了模拟探究.
资料显示,在煤中加入适量石灰石粉可使煤(含S)燃料时产生的SO2转化成钙盐,从而减少SO2排放,该方法被称为钙基固硫,某实验小组利用下列实验装置和药品对其可行性进行了模拟探究.