题目内容
8.在高温下赤热的焦炭能与水蒸气发生反应,对其反应后的生成物,探究小组同学作了如下探究:(1)猜想与假设
甲认为有H2、CO生成;
认为有H2、CO、CO2生成;
丙认为除有H2、CO、CO2外,可能还有N2生成.
探究小组组长丁认为丙同学的猜想不合理,丁同学做出判断的理论依据是质量守恒定律.
(2)设计与实验
甲、乙同学为了证明他们的猜想是正确的,设计了如图所示的实验装置:
(提示:无水硫酸铜遇到水变蓝色.)

①证明混合气体中含有H2,相应的现象是 装置C中的氧化铜由黑色变成红色,装置D中的无水硫酸铜由白色变为蓝色;
②证明混合气体中含有CO,相应的现象是装置C中的氧化铜由黑色变成红色,装置E中澄清石灰水变浑浊;
③证明混合气体中含有CO2,相应的现象是A中澄清石灰水变浑浊.
(3)丁同学认为此设计不够合理,应在A、B装置之间再加一个洗气瓶,内装氢氧化钠溶液,才能弥补上述设计的不足.
分析 (1)化学反应遵循质量守恒定律,即反应前后元素种类不变,原子种类和总个数不变;
(2)加热条件下,氢气和氧化铜反应生成铜和水,一氧化碳和氧化铜反应生成铜和二氧化碳;
二氧化碳能使澄清石灰水变浑浊;
氢氧化钠能和二氧化碳反应生成碳酸钠和水.
解答 解:(1)反应物中含有碳元素、氢元素和氧元素,生成物中应该含有碳元素、氢元素和氧元素,不含有氮元素,因此生成物中不可能含有氮气.
故填:质量守恒定律.
(2)如果含有一氧化碳,则一氧化碳和氧化铜反应生成铜和二氧化碳,装置C中的氧化铜由黑色变成红色,装置E中澄清石灰水变浑浊;
如果混合气体中含有二氧化碳,则A中的澄清石灰水变浑浊.
故填:装置C中的氧化铜由黑色变成红色,装置E中澄清石灰水变浑浊;A中澄清石灰水变浑浊.
(3)如果混合气体中含有二氧化碳,由于A中的澄清石灰水中氢氧化钙含量很少,可能不足以完全吸收二氧化碳,会影响对一氧化碳的测定,因此应在A、B装置之间再加一个洗气瓶,内装氢氧化钠溶液,如果含有二氧化碳时,二氧化碳能够被氢氧化钠溶液完全吸收.
故填:氢氧化钠.
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.

练习册系列答案
相关题目
8.下列关于氯化钠的用途,利用其化学性质的是( )
| A. | 溶液选种 | B. | 作融雪剂 | C. | 作调味品 | D. | 制碳酸钠 |
16.下列物质中不存在氧分子的是( )
| A. | 液态空气 | B. | 液态氧 | C. | 河水 | D. | 过氧化氢 |
3.从水分子分解示意图中我们能获得许多信息,其中描述错误的是( )


| A. | 这是一个化合反应 | B. | 分子在化学反应中可以再分 | ||
| C. | 在化学变化中原子是最小的粒子 | D. | 氢分子能保持氢气的化学性质 |
20.古语道“人要实,火要虚”,可燃物要架空一些,才能燃烧更旺.火要虚的目的是( )
| A. | 增大可燃物热值 | B. | 增大可燃物与空气接触面积 | ||
| C. | 降低可燃物的着火点 | D. | 增大空气中氧气的含量 |
18.5月31日是“世界无烟日”.吸烟对人体有害,吸烟产生的气体中含有一种能与血液中血红蛋白结合的有毒气体,它是( )
| A. | CO2 | B. | SO2 | C. | CO | D. | NO2 |
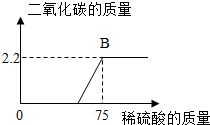 某化工厂排放的废水中含有碳酸钾和氢氧化钾,化学兴趣小组为探究废水中碳酸钾的含量,提取50g废水样品于集气瓶中,逐滴加入9.8%的稀硫酸,反应过程中产生二氧化碳的质量与加入稀硫酸的质量如下图,请计算:
某化工厂排放的废水中含有碳酸钾和氢氧化钾,化学兴趣小组为探究废水中碳酸钾的含量,提取50g废水样品于集气瓶中,逐滴加入9.8%的稀硫酸,反应过程中产生二氧化碳的质量与加入稀硫酸的质量如下图,请计算: