题目内容
8. 如图是甲和乙的溶解度曲线.
如图是甲和乙的溶解度曲线.(1)t2℃,向50g水中加入35g甲充分溶解得到溶液的溶质的质量分数37.5%;
(2)若要增大上述溶液中溶质的质量分数,其方法是升高温度.
分析 溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%;
根据物质的溶解度曲线可以判断增大质量分数的方法.
解答 解:(1)t2℃,甲的溶解度是60g,向50g水中加人35g甲充分溶解后,只能够溶解30g,得到溶液的溶质的质量分数为:$\frac{30g}{30g+50g}$×100%=37.5%;
(2)由于甲的溶解度随着温度的升高而增大,当升高温度时,剩余的5g甲继续溶解,溶质质量分数增大,因此可以通过升高温度的方法增大上述溶液中溶质的质量分数.
故填:37.5%;升高温度.
点评 溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.

练习册系列答案
相关题目
下列归纳总结完全正确的一组是
A. 化学之最 | B.化学与生活 |
①熔点最低的金属是汞 ②地壳中含量最高的金属元素是铁 ③天然存在的最硬的物质是金刚石 | ①衣服上的油污:可用汽油除去 ②水壶中的水垢:可加食盐水浸泡除去 ③冰箱中的异味:可放活性炭吸附 |
C.物质保存方法及解释 | D.化学与工农业 |
①浓盐酸密封保存:防止挥发 ②白磷在冷水中保存:隔绝空气 ③氢氧化钠密封保存:防止潮解、变质 | ①用焦炭和铁矿石炼铁 ②用石油产品生产合成纤维 ③施用过量化肥、农药增加粮食产量 |
A. A B. B C. C D. D
3.学习中你会发现化学知识中有“等”和“不等”.下列归纳叙述不正确的是( )
| A. | 化合物中正化合价代数和的绝对值等于负化合价代数和的绝对值 | |
| B. | 12g碳在12g氧气中充分燃烧,生成二氧化碳的质量等于24g | |
| C. | 10mL水和10mL酒精混合后的体积不等于20mL | |
| D. | 将20g某可溶性固体物质投入到80g水中充分溶解,所得溶液的质量不一定等于l00g |
13.为研究铝和铜的金属活动性,某研究小组进行如下探究.
(1)小明设计的实验方案是:将打磨的铝片和铜片分别放入稀盐酸中,观察反应的现象.写出铝与盐酸反应的化学方程式2Al+6HCl=2AlCl3+3H2↑.
(2)小芳将铝片放入氯化铜溶液中,看到有大量气泡逸出,且在一段时间内产生气泡越来越快,收集该气体可点燃,则生成的气体可能是氢气(或“H2”).
(3)小芳在(2)实验中,还观察到铝片与浓氯化铜溶液反应时还有“白色沉淀”这一异常现象.
【提出问题】铝片与浓氯化铜溶液反应反应出现的白色沉淀的组成是什么?
【查阅文献】①AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇.
②CuCl为白色固体,不溶于水、乙醇;溶于浓盐酸且溶液变蓝色.
【提出合理假设】
假设a:该白色沉淀可能含有CuCl(或者“CuCl”和“AlCl3”);
假设b:该白色沉淀可能含有AlCl3;
假设c:该白色沉淀可能含有Al.
【设计并完成实验】取白色沉淀分别进行如下实验:
【得出结论】实验①可判断假设c不成立(填“成立”或“不成立”),再结合实验②和③可得出该白色沉淀的成分是CuCl和AlCl3.
(4)室温时,小芳将等质量的相同铝片分别放入氯化铜溶液和硫酸铜溶液中,发现铝片和氯化铜溶液反应剧烈.
【发现问题】为什么铝片与氯化铜溶液反应比与硫酸铜溶液反应更剧烈呢?
【提出假设】①Cl-使铜盐和铝的反应容易进行.②氯化铜溶液和硫酸铜溶液的浓度不同所致.
【设计实验】为验证假设①是否正确,请设计一个合理的实验:取打磨的铝片放在一定体积的硫酸铜溶液中,滴加氯化钠溶液.
(1)小明设计的实验方案是:将打磨的铝片和铜片分别放入稀盐酸中,观察反应的现象.写出铝与盐酸反应的化学方程式2Al+6HCl=2AlCl3+3H2↑.
(2)小芳将铝片放入氯化铜溶液中,看到有大量气泡逸出,且在一段时间内产生气泡越来越快,收集该气体可点燃,则生成的气体可能是氢气(或“H2”).
(3)小芳在(2)实验中,还观察到铝片与浓氯化铜溶液反应时还有“白色沉淀”这一异常现象.
【提出问题】铝片与浓氯化铜溶液反应反应出现的白色沉淀的组成是什么?
【查阅文献】①AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇.
②CuCl为白色固体,不溶于水、乙醇;溶于浓盐酸且溶液变蓝色.
【提出合理假设】
假设a:该白色沉淀可能含有CuCl(或者“CuCl”和“AlCl3”);
假设b:该白色沉淀可能含有AlCl3;
假设c:该白色沉淀可能含有Al.
【设计并完成实验】取白色沉淀分别进行如下实验:
| 实验编号 | 实验操作 | 实验现象 |
| ① | 加入适量浓盐酸 | 无气泡,固体溶解,得到褐色溶液 |
| ② | 加入适量无水乙醇 | 固体部分溶解 |
| ③ | 加入适量浓氨水 | 固体部分溶解,得到蓝色溶液 |
(4)室温时,小芳将等质量的相同铝片分别放入氯化铜溶液和硫酸铜溶液中,发现铝片和氯化铜溶液反应剧烈.
【发现问题】为什么铝片与氯化铜溶液反应比与硫酸铜溶液反应更剧烈呢?
【提出假设】①Cl-使铜盐和铝的反应容易进行.②氯化铜溶液和硫酸铜溶液的浓度不同所致.
【设计实验】为验证假设①是否正确,请设计一个合理的实验:取打磨的铝片放在一定体积的硫酸铜溶液中,滴加氯化钠溶液.
18.安徽南北各地都有一些全国知名的小吃、名菜.下列名菜、名小吃中蛋白质含量最高的是( )
| A. |  蒙城牛肉 | B. |  涡阳苔干 | C. |  泾县香菜 | D. |  黄山烧饼 |
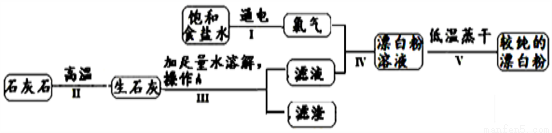
 2X+H2↑+Cl2↑,请写出X的化学式________________。请写出食盐水的另一日常用途 ____________________。
2X+H2↑+Cl2↑,请写出X的化学式________________。请写出食盐水的另一日常用途 ____________________。