题目内容
9. 长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到10.0g水垢后,产生CO2气体的情况如图所示.
长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到10.0g水垢后,产生CO2气体的情况如图所示.(1)水垢中碳酸钙的质量分数是多少?
(2)假设水垢中除碳酸钙和氢氧化镁外,不含有其它杂质,溶解10.0g水垢,至少需要质量分数为10.0%的盐酸的质量是多少(结果保留一位小数).
(3)若配制113.0g10.0%的稀盐酸,需用38%的浓盐酸(密度为1.19g/cm3)的体积是多少毫升?(结果精确到个位)
分析 (1)碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,氢氧化镁与稀盐酸反应生成氯化镁和水;由产生CO2气体的情况图,最终测试3.3g二氧化碳气体,由反应的化学方程式列式计算出参加反应的碳酸钙的质量、参加反应的稀盐酸中溶质的质量,进而计算出水垢中碳酸钙的质量分数.
(2)由水垢中氢氧化镁的质量,由反应的化学方程式列式计算出参加反应的稀盐酸中溶质的质量,进而计算出所需稀盐酸的质量.
(3)根据溶液稀释前后溶质的质量不变,结合题意进行分析解答.
解答 解:(1)设参加反应的碳酸钙的质量为x,与碳酸钙反应消耗的稀盐酸中溶质的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x y 3.3g
$\frac{100}{44}=\frac{x}{3.3g}$ x=7.5g
$\frac{73}{44}=\frac{y}{3.3g}$ y=5.475g
水垢中碳酸钙的质量分数是$\frac{7.5g}{10g}$×100%=75%.
(2)水垢中氢氧化镁的质量为10g-7.5g=2.5g.
设氢氧化镁完全反应消耗HCl的质量为z
2HCl+Mg(OH)2═MgCl2+2H2O
73 58
z 2.5g
$\frac{73}{58}=\frac{z}{2.5g}$ z≈3.147g
至少需要质量分数为10%的盐酸的质量为(5.475g+3.147g)÷10%≈86.2g.
(3)设需用38%的浓盐酸(密度为1.19g/cm3)的体积是x
1.19g/cm3×x×38%=113.0g×10.0% x≈25cm3(25mL)
答:(1)水垢中碳酸钙的质量分数是75%;(2)至少需要质量分数为10%的盐酸的质量为86.2g;(3)需用38%的浓盐酸(密度为1.19g/cm3)的体积是25mL.
点评 本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性.

| A. | 甲烷燃烧 | B. | 干冰升华 | C. | 汽油挥发 | D. | 西瓜榨汁 |
 有A,B两种金属放入等质量分数的稀硫酸中,生成氢气的质量与反应时间的关系如图所示,下列结论合理的是( )
有A,B两种金属放入等质量分数的稀硫酸中,生成氢气的质量与反应时间的关系如图所示,下列结论合理的是( )| A. | 金属活动性A>B | B. | 生成氢气的质量A>B | ||
| C. | 反应的硫酸质量A<B | D. | 反应的金属质量A<B |
①饱和溶液不能继续溶解某种溶质,则饱和溶液也不能继续溶解其他溶质;②Na2MoO4中钼(Mo)元素的化合价是+6价;③盐是由金属离子和酸根离子组成,NH4NO3中没有金属离子,不属于盐;④化学变化中,原子的种类和个数不变;⑤带电的微粒都称为离子;⑥NaOH溶液中的OH-能与酸反应,则KOH溶液中的OH-也能与酸反应.
| A. | ①②④ | B. | ②④⑥ | C. | ①③⑤ | D. | ③⑤⑥ |
| A. | 静置 | B. | 煮沸 | C. | 过滤 | D. | 吸附 |
| A. | 配制溶液时,只能用水作溶剂 | |
| B. | 配制硝酸铵溶液的过程中,溶液的温度会下降 | |
| C. | 用浓硫酸配制稀硫酸时,应将水缓缓注入浓硫酸中 | |
| D. | 将10g氯化钠溶于100g水中,得到质量分数为10%的氯化钠溶液 |
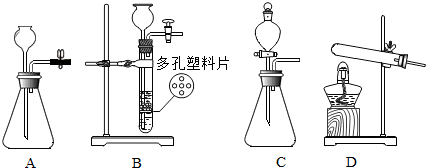
| A. |  收集氧气时,氧气的验满 | B. |  比较镁与铁的金属活动性 | ||
| C. |  验证白磷的着火点低于红磷 | D. |  验证生石灰与水反应放热 |
| A. |  向氢氧化钠溶液中加水 | |
| B. |  向一定质量的稀盐酸中持续加入碳酸钠溶液 | |
| C. |  向氯化钠饱和溶液中加入氯化钠固体 | |
| D. |  向硫酸铜溶液中加入氢氧化钠溶液 |