题目内容
兴趣小组的同学为测定某一铁铜合金中含铁的质量分数,将6g该合金粉末样品,加入溶质质量分数为10%的硫酸铜溶液160g中,二者恰好完全反应。同时为了充分利用资源,还对反应后的物质进行回收处理。请结合下列图示计算:
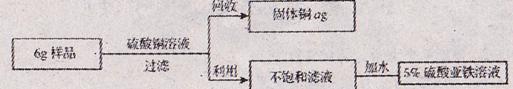
(1)该合金样品中含铁的质量分数;(计算结果精确至0.1%)
(2)所的固体铜的质量a为多少g?
(3)向不饱和滤液中加入多少g水,能得到5%的硫酸亚铁溶液,用于花卉的营养液,计算结果精确至0.1g。
【答案】 (1)93.3% (2)6.8g (3)144.8g
【解析】解:设合金中铁的质量为x,生成的硫酸亚铁的质量为y,铜的质量为z。
(1)硫酸铜的质量为:160×10%=16g
Fe+CuSO4 = FeSO4 + Cu
56 160 152 64
x 16g z y
56/x=160/16g
x=5.6g
5.6g/6g×100%=93.3%
(2)160/16g=64/y
y=6.4g
6.4g+(6g-5.6 g)=6.8g
g)=6.8g
(3)160/16g=152/z
Z=15.2g
15.2g/5%=304g
304g-(160g+5.6g-6.4g)=144.8g

 钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量。某补钙药剂说明书的部分信息如右图所示。现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图像如下。请根据有关信息回答问题。
钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量。某补钙药剂说明书的部分信息如右图所示。现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图像如下。请根据有关信息回答问题。
| 第1次 | 第3次 | 第4次 | |
| 加入盐酸的质量(g) | 20 | 20 | 20 |
| 剩余固体的质量(g) | 35 | a | 20 |


(1) 人体缺钙易出现的疾病是 ,这时除在医生指导下服用保健药剂外,日常生活中要多摄入 等食物。
人体缺钙易出现的疾病是 ,这时除在医生指导下服用保健药剂外,日常生活中要多摄入 等食物。
(2)该品牌补钙药剂中CaCO3的质量分数是 ,a的数值为 。
(3)求该盐酸中溶质的质量分数为(写出计算过程,计算结果保留一位小数)。
硅钢是变压器、充电器中的核心材料,其主要成份是Fe和Si。某学生用硅钢样品做了如下实验:取4.2g硅钢样品,将60g稀硫酸分6次加入样品中(其中稀硫酸与硅及其它杂质不反应),充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
| 稀硫酸的用量 | 剩余固体的质量 |
| 第一次加入10g | mg |
| 第二次加入10g | 2.8g |
| 第三次加入10g | 2.1g |
| 第四次加入10g | 1.4g |
| 第五次加入10g | 0.7g |
| 第六次加入10g | 0.7g |
(1)从以上数据可知,稀硫酸加入第 70 次充分反应后,铁恰好完全反应。
(2)表格中m= 71 。
(3)计算所用稀硫酸中溶质的质量分数。72
 H =7.将生成的沉淀滤出,经水洗、干燥后称
H =7.将生成的沉淀滤出,经水洗、干燥后称 重为10.7g.
重为10.7g.

 实验室里用A装置制取氧气的化学方程式为______________________________,可选择的收集装置有______。若要得到干燥的氧气,所选择装置的连接顺序为______。
实验室里用A装置制取氧气的化学方程式为______________________________,可选择的收集装置有______。若要得到干燥的氧气,所选择装置的连接顺序为______。 。
。