题目内容
10.甲、乙、丙三位同学对氯化镁固体样品(仅含杂质NaCl)进行如下实验:各取5.0g样品溶于一定量的水中,得到25.0g溶液,再加入不同质量,溶质质量分数为10%的氢氧化钠溶液,反应得到沉淀的质量如下表所示:| 甲 | 乙 | 丙 | |
| 加入NaOH溶液的质量/g | 35.0 | 40.0 | 45.0 |
| 反应后过滤得到沉淀的质量/g | 2.5 | 2.9 | 2.9 |
(1)判断乙同学进行的实验是氢氧化钠与氯化镁恰好完全反应的.
(2)计算上述实验中符合(1)要求的同学所得滤液中溶质的质量分数(计算结果精确至0.1%).
分析 (1)分析表中生成沉淀与所加氢氧化钠溶液的关系,判断出所用的氢氧化钠溶液一定过量的一组实验;
(2)乙同学实验后溶液中NaCl的质量=样品质量-MgCl2的质量+反应生成的NaCl的质量;乙同学实验后溶液的质量=样品溶液质量+实验用氢氧化钠溶液的质量-生成沉淀的质量;然后根据溶质质量分数进行计算.
解答 解:(1)由甲的实验数据可知,加入20.0g氢氧化钠溶液可生成1.45g沉淀;乙实验加入40.0g氢氧化钠溶液得到2.9g沉淀,而丙实验加入60.0g氢氧化钠溶液,得到沉淀质量仍为2.9g,因此可确定丙所用氢氧化钠溶液一定过量,且乙实验中氢氧化钠与氯化镁恰好完全反应;
(2)设氯化镁的质量为x,生成氯化钠的质量为y.
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
95 58 117
x 2.9 g y
$\frac{95}{x}=\frac{58}{2.9g}=\frac{117}{y}$
x=4.75 g
y=5.85 g
所得溶液中NaCl的质量为:5g-4.75g+5.85g=6.1g
所得溶液的质量为:25.0 g+40 g-2.9 g=62.1 g
所得溶液中溶质的质量分数为:$\frac{6.1g}{62.1g}$×100%=9.8%
答:
(1)乙
(2)所得滤液中溶质的质量分数为9.8%.
点评 本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

| A. | NO3- Fe3+ Na+ OH- | B. | K+ SO42- Na+ NO3- | ||
| C. | C1- K+ SO42- Ba2+ | D. | Ca2+ Cl- CO32- Na+ |
| A | B | C | D |
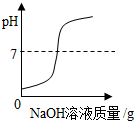 |  | 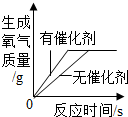 |  |
| 向一定量稀盐酸中加入过量氢氧化钠溶液 | 向一定量硫酸和硫酸铜混合溶液中加入过量的氢氧化钠溶液 | 用等质量、等溶质质量分数的双氧水分别制取氧气 | 向饱和澄清石灰水中加入固体CaO (恢复至原温度) |
| A. | A | B. | B | C. | C | D. | D |

| A. | 2CO+O2═2CO2 化合反应 | B. | 2HI+Cl2═2HCl+I2 置换反应 | ||
| C. | 2H2O═2H2↑+O2↑分解反应 | D. | 2HCl+CuO═CuCl2+H2O 复分解反应 |
| A. | 滴入适量CuSO4溶液,无蓝色沉淀生成 | |
| B. | 加入适量碳酸钠,无气泡产生 | |
| C. | 滴加紫色石蕊试液,溶液为紫色 | |
| D. | 滴入适量的BaCl2溶液,观察到有白色沉淀 |
 市售的碳酸氢钠片是一种白色片状药剂,主要成份为碳酸氢钠(NaHCO3),用于缓解胃酸过多引起的胃痛、胃灼热感(烧心)、反酸等有关症状,根据题意,试回答以下问题:
市售的碳酸氢钠片是一种白色片状药剂,主要成份为碳酸氢钠(NaHCO3),用于缓解胃酸过多引起的胃痛、胃灼热感(烧心)、反酸等有关症状,根据题意,试回答以下问题: