题目内容
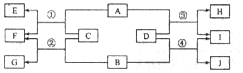
12.在20℃时,配制100g溶质质量分数为5%的氯化钠溶液,以下是实验操作示意图,请回答下列问题.
(1)上述实验操作中有一处明显的错误,请指出:A(填序号).C中玻璃棒的作用是搅拌,加快溶解速率.
(2)配制上述溶液需要氯化钠的质量为5g,应该选择100(填“10”、“50”或“100”)ml的量筒量取所需的水.
(3)操作步骤可概括为:计算、称量、量取、溶解、装瓶贴标签等.
(4)误差分析:在量取水的体积时如果俯视读数,则导致所配溶液的溶质质量分数偏大(填“偏大”、“偏小”或“不变”).
(5)若将100g 5%的氯化钠溶液质量分数增大一倍,应蒸发50克水.
分析 (1)根据托盘天平的使用要遵循“左物右码”的原则,C是溶解操作,进行分析解答.
(2)利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算配制溶液所需要的溶质的质量;再根据溶剂质量=溶液质量-溶质质量即可求得水的质量,进而确定所需量筒的量程.
(3)根据配制溶质质量分数一定的溶液的步骤,进行分析解答.
(4)在量取水的体积时如果俯视读数,读数比实际液体体积大,进行分析解答.
(5)根据溶液蒸发前后溶质的质量不变,进行分析解答.
解答 解:(1)托盘天平的使用要遵循“左物右码”的原则,图A中所示操作砝码与药品位置放反了.
C是溶解操作,玻璃棒的作用是搅拌,加快溶解速率.
(2)溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为5%的氯化钠溶液,需氯化钠的质量=100g×5%=5g;溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-5g=95g(合95mL);应用规格为100mL的量筒量取水的体积.
(3)配制100g溶质质量分数为5%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解.
(4)在量取水的体积时如果俯视读数,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大.
(5)设要蒸发水的质量为x,根据溶液蒸发前后溶质的质量不变,
则100g×5%=(100g-x)×10% x=50g.
故答案为:(1)A;搅拌,加快溶解速率;(2)5;100;(3)称量;(4)偏大;(5)50.
点评 本题难度不大,掌握配制溶质质量分数一定的溶液的步骤(计算、称量、溶解)、溶质质量=溶液质量×溶质的质量分数、溶剂质量=溶液质量-溶质质量等是正确解答本题的关键.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
3.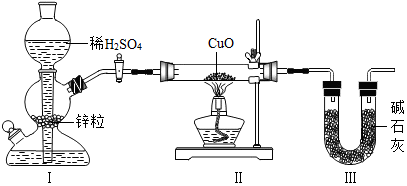 用如图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管(包 括氧化铜)的质量差和 U 型管(包括碱石灰)的质量差,计算得氢元素和氧元素的质量比 大于 1﹕8.下列对导致这一结果的原因的分析中合理的是( )
用如图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管(包 括氧化铜)的质量差和 U 型管(包括碱石灰)的质量差,计算得氢元素和氧元素的质量比 大于 1﹕8.下列对导致这一结果的原因的分析中合理的是( )
 用如图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管(包 括氧化铜)的质量差和 U 型管(包括碱石灰)的质量差,计算得氢元素和氧元素的质量比 大于 1﹕8.下列对导致这一结果的原因的分析中合理的是( )
用如图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管(包 括氧化铜)的质量差和 U 型管(包括碱石灰)的质量差,计算得氢元素和氧元素的质量比 大于 1﹕8.下列对导致这一结果的原因的分析中合理的是( )| A. | I、Ⅱ装置之间缺少干燥装置 | |
| B. | III 装置干燥剂量不足,水没有被完全吸收 | |
| C. | CuO 没有全部被还原 | |
| D. | Ⅱ装置中玻璃管内有水冷凝 |
4.下列实验对应的图象正确的是( )
 |  |  |  |
| A、分别向等质量的镁和锌中滴加足量的盐酸 | B、向pH=2的盐酸中滴加过量的氢氧化钠溶液 | C、向BaCl2和NaOH混合溶液中逐滴加入稀硫酸至过量 | D、向盐酸和氯化铜的混合溶液中加氢氧化钾溶液 |
| A. | A | B. | B | C. | C | D. | D |
1.某种有机物3.2g在氧气中完全燃烧,生成二氧化碳4.4g和水3.6g,下列对该有机物的判断正确的是( )
| A. | 该有机物一定含有碳、氢元素,可能含有氧元素 | |
| B. | 该有机物中碳、氢、氧元素的质量比为3:1:4 | |
| C. | 该有机物的化学式为CH4 | |
| D. | 该有机物的化学式为C2H5OH |