题目内容
17.食盐是一种重要的化工原料.请回答下列问题.(1)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤.

①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和漏斗.
②在蒸发过程中,待蒸发皿中出现较多固体时,停止加热,利用余热将滤液蒸干.
③除去不溶性杂质实验中用得最多的仪器是玻璃棒.
(2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制.流程如下图.
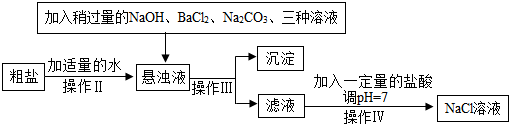
①加入Na2CO3溶液发生的化学反应用化学方程式可表示为Na2CO3+BaCl2=BaCO3↓+2NaCl、Na2CO3+CaCl2=CaCO3↓+2NaCl.
②过滤后得到的沉淀除有氢氧化镁、碳酸钙、硫酸钡外,还有碳酸钡;所得滤液中的溶质除NaCl外,还有Na2CO3和NaOH,在蒸发食盐水时为防止液滴飞溅,操作时应连续搅拌,还应在出现较多量晶体时停止加热.
③加入稀盐酸发生的化学反应,可以用方程式表示:NaOH+HCl=NaCl+H2O、Na2CO3+2HCl=2NaCl+H2O+CO2↑.
(3)在除去MgCl2的过程中,选择的除杂的试剂不能用KOH代替NaOH,理由是引入杂质,得到的产品不纯.
(4)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒,理由是碳酸钠作用是既除去Ca2+,又除去多余的氯化钡.
分析 (1)根据粗盐提纯的步骤和仪器以及注意事项进行分析;
(2)①根据碳酸钠的性质来分析;
②根据除杂质的原理以及蒸发结晶的操作来分析;
③根据盐酸的性质来分析;
(3)根据氢氧化钾会引入杂质进行解答;
(4)碳酸钠作用是既除去Ca2+,又除去多余的氯化钡.
解答 解:(1)去除泥沙的步骤是:①溶解:把粗盐放入烧杯中,加水溶解;②过滤:架好漏斗,使漏斗下端口紧贴烧杯内壁,沿玻璃棒把上述悬浊液慢慢导入漏斗中;该过程中用到的玻璃仪器主要有烧杯、玻璃棒和漏斗等;③蒸发结晶:将上述滤液倒入蒸发皿中,用酒精灯加热蒸发,待蒸发皿中出现较多量晶体时即停止加热;除去不溶性杂质实验中用得最多的仪器是玻璃棒;故填:①漏斗;②蒸发皿中出现较多固体;③玻璃棒;
(2)①碳酸钠可以除去反应中过量的氯化钡和氯化钙,碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程式分别为:Na2CO3+BaCl2=BaCO3↓+2NaCl、Na2CO3+CaCl2=CaCO3↓+2NaCl;故填:Na2CO3+BaCl2=BaCO3↓+2NaCl、Na2CO3+CaCl2=CaCO3↓+2NaCl;
②碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,所以沉淀还有碳酸钡沉淀;为了把杂质除净,加入的氯化钡、氢氧化钠和碳酸钠都过量,过量的氯化钡被后面的碳酸钠反应掉了,但过量的氢氧化钠和碳酸钠都进入了滤液中;蒸发时待大部分晶体结晶析出后停止加热,靠余热将剩余晶体再结晶析出.故填:碳酸钡;NaOH;在出现较多量晶体时停止加热;
③盐酸能与氢氧化钠反应生成氯化钠和水,与碳酸钠反应生成氯化钠、水和 二氧化碳,故填:NaOH+HCl=NaCl+H2O、Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(3)选择的除杂试剂不能用KOH代替NaOH,理由是引入杂质,得到的产品不纯;故填:引入杂质,得到的产品不纯;
(4)在制备精盐的过程中,由于加入的氯化钡和碳酸钠都是过量的,加入碳酸钠一方面是除去Ca2+,同时还除去多余的氯化钡.故填:碳酸钠作用是既除去Ca2+,又除去多余的氯化钡.
点评 本题考查了常见物质间的转化,完成此题,可以依据已有的物质的性质进行.书写反应的化学方程式要注意配平.

| 反应前 | 反应后 |
| 石灰石样品质量6.0克 | 杯内物质总质量 63.8克 |
| 稀盐酸质量60.0克 | |
| 烧杯质量100.0克 | 烧杯质量100.0克 |
(2)样品中碳酸钙的质量为5克
(3)求反应后所得溶液溶质的质量分数?