题目内容
7.做硫在氧气中燃烧时,在集气瓶内放入少量水来吸收SO2,实验结束后,集气瓶内仍残留一定量的SO2.围绕如何处理这些SO2的问题,同学们进行了有关探究.【提出问题】:SO2是形成酸雨的主要物质.选用NaOH溶液吸收SO2效果如何?
【实验验证】:用两套完全相同的装置做对比实验(SO2不溶于植物油,也不与其反应),设计装置如下图所示.
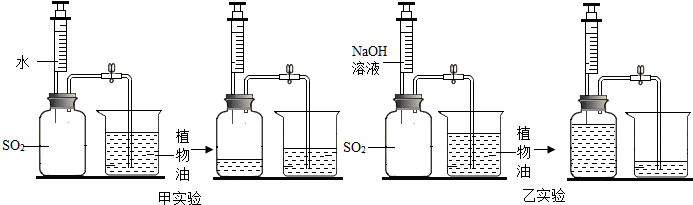
(1)为确保实验的准确性,首先要检查装置的气密性.
(2)实验开始时,先用弹簧夹加紧乳胶管,再用注射器内等体积的水和NaOH溶液分别注入充满SO2的集气瓶.
(3)充分吸收SO2后打开弹簧夹,观察试验后进入两个集气瓶内植物油的体积.
【结论解释】:
(4)写出甲实验中,SO2与水反应的化学方程式SO2+H2O=H2SO3,可用pH试纸 来测定该溶液的酸碱度.
(5)写出乙实验中,SO2与NaOH溶液反应的化学方程式SO2+2NaOH=Na2SO3+H2O.
(6)分析实验现象可知,吸收SO2效果好的是乙实验(填“甲实验”或“乙实验”).
【拓展迁移】:
(7)在工业上常用氨水(NH3的H2O溶液)来吸收SO2,得到的(NH4)2SO3可用作化肥,写出该反应的化学方程式2NH3+H2O+SO2=(NH4)2SO3,考虑氨水的毒性及挥发性,这种方法在实验室中一般不使用.
(8)在必须用煤作燃料的情况下,要减少二氧化硫的排放,请你提出一条合理化的建议用碱液吸收产生的SO2.
分析 实验过程中有气体参加时应该检验装置的气密性;根据反应物和生成物及其质量守恒定律可以书写化学方程式;用PH试纸可以测定溶液的酸碱度;显碱性的溶液容易与二氧化硫反应.
解答 解:(1)为确保实验的准确性,要先检查装置的气密性.故填:气密性.
【结论与解释】
(1)甲实验中,SO2溶于水且与水反应生成H2SO3,反应的化学方程式为:SO2+H2O=H2SO3.
可以用pH试纸来测定该溶液的酸碱度;故填:SO2+H2O=H2SO3;pH试纸.
(2)二氧化硫可以与氢氧化钠反应生成亚硫酸钠和水,化学方程式为:SO2+2NaOH=Na2SO3+H2O;故填:SO2+2NaOH=Na2SO3+H2O;
(3)由实验现象得知,用碱性溶液比用水吸收SO2的效果好.故填:乙实验.
【拓展与迁移】
(1)氨水(NH3的H2O溶液)来吸收SO2,得到的(NH4)2SO3,化学方程式为:2NH3+H2O+SO2=(NH4)2SO3.故填:2NH3+H2O+SO2=(NH4)2SO3.
(2)在必须用煤作燃料的情况下.要减少SO2的排放,可以用碱液吸收产生的SO2.故填:用碱液吸收产生的SO2.
点评 解答本题要掌握化学方程式的书写方法和各种物质的性质方面的知识,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
相关题目
2.仅有烧杯、试管、漏斗、量筒、铁架台、酒精灯、集气瓶、玻璃片、水槽、带导管的胶塞,不能完成的实验是( )
| A. | 制氢气 | B. | 粗盐提纯 | C. | 制氧气 | D. | 配制15%的食盐水 |




 属于单质(填“单质”或“化合物”).
属于单质(填“单质”或“化合物”).