题目内容
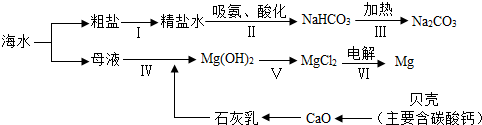
6.混合物分离的方法有多种.下列事例中各采取了什么分离方法.(1)除去CaCl2溶液中混有的盐酸,可以加人过量的碳酸钙充分反应后过滤.
(2)要分离FeCl3和KCl的混合溶液,可以先加入适量的氢氧化钾溶液形成红褐色沉淀后,将沉淀过滤出来后,再加入适量的稀盐酸即可.
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:(1)要除去除去CaCl2溶液中混有的盐酸,实质就是除去氢离子,可利用盐酸能与过量的碳酸钙反应生成氯化钙、水和二氧化碳,再过滤除去过量的碳酸钙,能除去杂质且没有引入新的杂质,符合除杂原则,然后过滤即可,能除去杂质且没有引入新的杂质,符合除杂原则.
(2)要分离FeCl3和KCl的混合溶液,可以先加入适量的氢氧化钾溶液,氢氧化钾与氯化铁溶液反应生成氢氧化铁沉淀和氯化钾,将沉淀过滤出来后,再加入适量的稀盐酸,氢氧化铁沉淀与稀盐酸反应生成氯化铁和水,从而实现分离.
故答案为:(1)碳酸钙;(2)氢氧化钾;稀盐酸.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

练习册系列答案
相关题目
8.要除去氯化钠溶液中混有的少量碳酸钠杂质,可以加入适量的( )
| A. | 澄清石灰水 | B. | 氯化钾溶液 | C. | 硝酸银溶液 | D. | 盐酸 |
14.某化学兴趣小组学习氢氧化钠的性质之后展开探究性学习,请你作为该小组成员一起来解决下列问题;
(1)小红同学用下图总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应)
I.依据反应④说明,NaOH必须密封保存,否则在空气中要变质;其化学反应方程式为CO2+2NaOH=Na2CO3+H2O
II.为了验证反应③能够发生,你选择的物质是c(填序号).
a.Na2CO3 b. HCl c.CuSO4 d. Ba(NO3)2
(2)氢氧化钠溶液能使无色酚酞溶液变红色,且其中含有H2O、Na+、OH-三种微粒,小组同学想进一步探究是哪种微粒使无色酚酞溶液变红色.
【提出猜想】猜想①:可能是H2O;
猜想②:可能是Na+;
猜想③:可能是OH-.
【实验验证】
【讨论反思】有同学认为猜想①不需要实验验证就可以排除,你认为该同学的理由是无色酚酞试液中有大量水分子,已经证明水分子不能使酚酞变红色.
(1)小红同学用下图总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应)

I.依据反应④说明,NaOH必须密封保存,否则在空气中要变质;其化学反应方程式为CO2+2NaOH=Na2CO3+H2O
II.为了验证反应③能够发生,你选择的物质是c(填序号).
a.Na2CO3 b. HCl c.CuSO4 d. Ba(NO3)2
(2)氢氧化钠溶液能使无色酚酞溶液变红色,且其中含有H2O、Na+、OH-三种微粒,小组同学想进一步探究是哪种微粒使无色酚酞溶液变红色.
【提出猜想】猜想①:可能是H2O;
猜想②:可能是Na+;
猜想③:可能是OH-.
【实验验证】
| 实 验 操 作 | 实 验 现 象 | 结 论 |
| ①用试管取少量蒸馏水,滴入1-2滴无色酚酞试液,振荡 | 试管内溶液仍为无色 | 水分子不能使无色酚酞试液变红色 |
| ②用试管取少量氯化钠溶液,滴入1-2滴无色酚酞试液,振荡 | 振荡试管内溶液仍为无色 | Na+不能使无色酚酞试液变红色 |
| ③用试管取少量氢氧化钠溶液,滴入1-2滴无色酚酞试液,振荡 | 试管内溶液变为红色 |
11. 某学习小组在探究酸的化学性质时,做了如图所示的两个实验:
某学习小组在探究酸的化学性质时,做了如图所示的两个实验:
(1)分别向两支装有碳酸钠和碳酸钙粉末的试管中注入一定量的稀盐酸,两支试管内均观察到的现象是有气泡产生,固体粉末全部消失,最终形成无色溶液.实验结束后,同学们将A、B两支试管中的废液倒入同一只洁净的烧杯中,发现烧杯中的废液变浑浊.写出产生浑浊现象的化学方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl.
(2)小组同学将烧杯中的物质进行了过滤,对滤液中的溶质成分展开了探究,请你一起参与.
【提出猜想】猜想1:滤液中的溶质是氯化钠;
猜想2:滤液中的溶质是氯化钠和碳酸钠;
猜想3:滤液中的溶质是氯化钠和氯化钙.
【设计实验】请你对猜想2进行验证.
 某学习小组在探究酸的化学性质时,做了如图所示的两个实验:
某学习小组在探究酸的化学性质时,做了如图所示的两个实验:(1)分别向两支装有碳酸钠和碳酸钙粉末的试管中注入一定量的稀盐酸,两支试管内均观察到的现象是有气泡产生,固体粉末全部消失,最终形成无色溶液.实验结束后,同学们将A、B两支试管中的废液倒入同一只洁净的烧杯中,发现烧杯中的废液变浑浊.写出产生浑浊现象的化学方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl.
(2)小组同学将烧杯中的物质进行了过滤,对滤液中的溶质成分展开了探究,请你一起参与.
【提出猜想】猜想1:滤液中的溶质是氯化钠;
猜想2:滤液中的溶质是氯化钠和碳酸钠;
猜想3:滤液中的溶质是氯化钠和氯化钙.
【设计实验】请你对猜想2进行验证.
| 实验步骤 | 预计实验现象 | 预计结论 |
| 取少量溶液于试管中, 加入少量的稀盐酸 | 产生气泡 | 猜想2正确 |
15.用于家庭装修的白色涂料中常添加二氧化钛(TiO2),其中Ti的化合价为( )
| A. | +2 | B. | +4 | C. | -2 | D. | -4 |
16. 如表提供了A、B两种物质的溶解度数据,读取信息后回答:
如表提供了A、B两种物质的溶解度数据,读取信息后回答:
(1)A、B物质都属于易溶 物质(填“难溶”、“微溶”、“可溶”或“易溶”);
(2)A、B两物质溶解度随温度变化趋势的不同是:A的溶解度变化小,B的溶解度变化大;
(3)如图给出的曲线中,③与A物质溶解度的变化趋势相符(填曲线编号);
(4)从A、B两物质的混合物中分离出B物质,一般采用降温结晶的方法.
 如表提供了A、B两种物质的溶解度数据,读取信息后回答:
如表提供了A、B两种物质的溶解度数据,读取信息后回答:| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 物质A | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 |
| 物质B | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
(2)A、B两物质溶解度随温度变化趋势的不同是:A的溶解度变化小,B的溶解度变化大;
(3)如图给出的曲线中,③与A物质溶解度的变化趋势相符(填曲线编号);
(4)从A、B两物质的混合物中分离出B物质,一般采用降温结晶的方法.