题目内容
7.为测定21.2g某变质氢氧化钠固体中碳酸钠的含量,将其配置成500mL溶液,分别取出50mL用两种方法进行测定.| 加入的试剂 | 测得的数据 | |
| 方法1 | 足量BaCl2溶液 | BaCO3沉淀1.97g |
| 方法2 | 足量稀硫酸 | CO2气体0.44g |
(2)欲向上述用剩的溶液中加入15.39 g Ba(OH)2,过滤,则获得纯净的氢氧化钠溶液.
(3)有一长久暴露于空气中的NaOH固体,经分析知其含水7.65%,含Na2CO34.32%,其余是NaOH.若取此样品1g放入100g3.65%的稀盐酸中充分反应,残余的酸再用10g30.9%的NaOH溶液恰好完全中和.将反应后的溶液蒸干,得到固体的质量是5.85 g.
分析 (1)根据碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,依据题中的数据减小计算;
(2)根据碳酸钠和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,依据碳酸钠的质量进行计算;
(3)因为100g3.65%的稀盐酸与碳酸钠、氢氧化钠溶液都反应,因为“完全中和”,故氯元素全部与钠元素,生成氯化钠;先求出100g3.65%的稀盐酸的氯元素的质量,则可求出氯化钠的质量.
解答 解:(1)方法一 设参加反应的碳酸钠的质量为m
Na2CO3+BaCl2=BaCO3↓+2NaCl
106 197
m 1.97g
$\frac{106}{x}$=$\frac{197}{1.97g}$
m=1.06g
所以样品中,碳酸钠的质量=1.06g×$\frac{500mL}{50mL}$=10.6g
样品中,ω(Na2CO3)=$\frac{10.6g}{21.2g}$×100%=50%;
方法二 设参加反应的碳酸钠的质量为n
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
n 0.44g
$\frac{106}{n}$=$\frac{44}{0.44g}$
n=1.06g
则样品中,碳酸钠的质量=1.06g×$\frac{500mL}{50mL}$=10.6g
样品中,ω(Na2CO3)=$\frac{10.6g}{21.2g}$×100%=50%;
(2)设与碳酸钠反应的氢氧化钡的质量为x
Ba(OH)2+Na2CO3=BaCO3↓+2NaOH
171 106
x 1.06g×$\frac{450mL}{50mL}$
$\frac{171}{x}$=$\frac{106}{10.6g×0.9}$
x=15.39g
(3)因为100g3.65%的稀盐酸与碳酸钠、氢氧化钠溶液都反应,因为“完全中和”,故氯元素全部与钠元素,生成氯化钠,则:100g3.65%的稀盐酸的氯元素的质量为:100×3.65%×$\frac{35.5}{36.5}$×100%=3.55克,所以3.55÷$\frac{35.5}{58.5}$×100%=5.85克,故将反应后的溶液蒸干,得到固体的质量是5.85克.
故答案为:(1)50%;
(2)15.39;
(3)5.85.
点评 本题是运用化学中的基本思想质量守恒思想,通过化合物中某元素的质量分数的计算,从而培养了学生的创新思维能力.

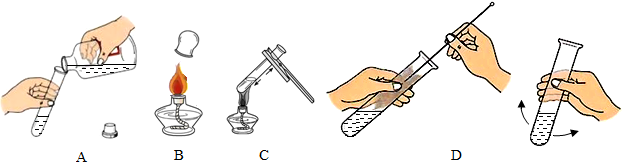
| 实验操作 | 现象 | 结论 | |
| 第1组 | 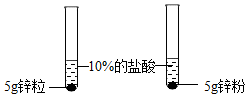 | ①锌粉(选填“锌粒”或“锌粉”)反应更加剧烈. | 反应物表面积越大,反应速率越大. |
| 第2组 | 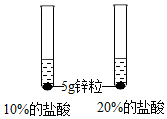 | 锌粒与20%的盐酸反应更加剧烈. | 反应物②浓度越大,反应速率越大. |
| 第3组 | 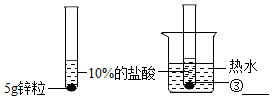 | 置于热水的试管反应更加剧烈. | 温度越高,反应的速率越大. |
(2)请写出锌与稀盐酸反应的化学方程式Zn+2HCl=ZnCl2+H2↑
(3)为了提高铁与盐酸反应的反应速率,请提出一种实验方案使用铁粉(或增大盐酸浓度;或加热等合理答案皆可)
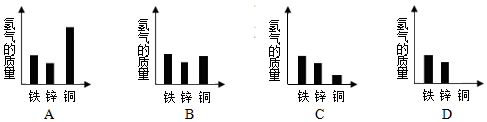
(4)综合其它实验结果,相同质量的铁、锌、铜与足量的稀盐酸反应产生氢气的质量关系如图,其中正确的是D(填选项)
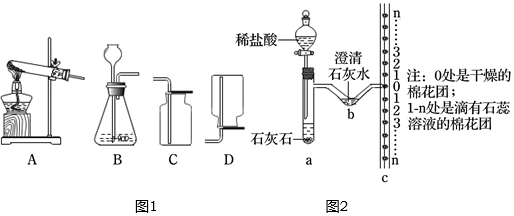
 为了测定某品牌小苏打样品中碳酸氢钠的质量分数,兴趣小组进行了如图所示的实验(假设该样品中只含有氯化钠一种杂质),注:实验过程中发生反应的化学方程式是NaHCO3+HCl═NaCl+H2O+CO2↑.
为了测定某品牌小苏打样品中碳酸氢钠的质量分数,兴趣小组进行了如图所示的实验(假设该样品中只含有氯化钠一种杂质),注:实验过程中发生反应的化学方程式是NaHCO3+HCl═NaCl+H2O+CO2↑. 在“宏观-微观-符号”之间建立联系,是学习化学的一种重要思维方式.
在“宏观-微观-符号”之间建立联系,是学习化学的一种重要思维方式.
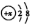 ,则x的值为8.
,则x的值为8.