题目内容
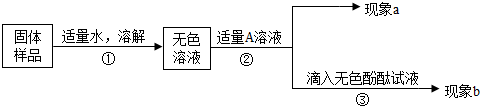
13. 同学们在初中化学实验室中发现一瓶久置的、瓶口有白色固体、瓶塞丢失的无色溶液,如图所示.已知原溶液可能是NaCl、NaOH或Na2CO3三种溶液中的一种,为确定该溶液的成分,同学们进行了如下探究:
同学们在初中化学实验室中发现一瓶久置的、瓶口有白色固体、瓶塞丢失的无色溶液,如图所示.已知原溶液可能是NaCl、NaOH或Na2CO3三种溶液中的一种,为确定该溶液的成分,同学们进行了如下探究:小张同学取待测液测得pH=10,他得出的关于溶液成分的结论是溶液可能是NaOH或Na2CO3他再取少量待测液于试管中,加入过量的稀HCl,观察到有气泡冒出,由此小张同学认为,溶液为Na2CO3溶液.
小李同学对小张同学的结论提出疑问,又进行了以下实验:取少量待测液于试管中,加入过量的CaCl2溶液,生成白色沉淀,静置,滴入酚酞,无明显颜色变化(写出还需进行的操作及现象).通过实验,小李同学认为小张同学的结论正确.
二位同学给试剂瓶贴了一个新标签:Na2CO3.
【反思与讨论】
(1)小李同学加入过量CaCl2溶液的目的是完全转化碳酸根离子,消除碱性干扰.
(2)你认为两位同学的结论一定正确吗?理由是什么?
分析 本题要验证是否为对应的溶液,而题目给出的情景是久置的,瓶口有固体,瓶塞丢失,那么溶质也可能会变质或者是部分变质,所以情况就应该是多种了.对应的原溶液的三种情况监测时会出现:NaCl、NaOH和Na2CO3(氢氧化钠部分变质);Na2CO3(氢氧化钠完全变质);Na2CO3四种情况.
解答 解:小张同学取待测液测得pH=10,也就是溶液显碱性,所以就可能是原溶液为氢氧化钠或者是碳酸钠.此时加入盐酸生成气泡,说明现在的溶液是含有碳酸钠的,但是这个碳酸钠是本来就是碳酸钠呢还是氢氧化钠变质所生成的碳酸钠呢?就不能确定了.所以小张同学的结论是不正确的.
小李取少量待测液于试管中,加入过量的CaCl2溶液,生成白色沉淀,静置,滴入酚酞,目的是将碳酸根离子转为为沉淀,使碱性不存在,确定溶液为碳酸钠,但是此时但是这个碳酸钠是本来就是碳酸钠呢还是氢氧化钠完全变质所生成的碳酸钠呢?
所以两个方案设计原理都有错误之处,都是不科学的.
二位同学给试剂瓶贴了一个新标签:Na2CO3.
答案为:NaOH或Na2CO3; 有气泡冒出;滴入酚酞,无明显颜色变化;
(1)全转化碳酸根离子,消除碱性干扰;
(2)都不正确;无法确定碳酸钠是本来就是碳酸钠呢还是氢氧化钠(部分变质或者完全变质)变质所生成的碳酸钠.
点评 本题考查了探究物质的组成,根据物质的特殊性质来分析解答即可,难度不大,注意:为防止干扰氢氧化钠的检验,检验碳酸根离子的物质不能用碱性物质或反应后生成碱性物质的物质,为易错点.

练习册系列答案
相关题目
11. 在学习盐酸的化学性质时,小明和小芳两位同学分别做了碳酸钠溶液和稀盐酸溶液的化学实验(如图).小明的实验中能观察到有气泡产生,小芳的实验中观察不到有气泡产生,对此意外现象,两位同学进行如下探究:
在学习盐酸的化学性质时,小明和小芳两位同学分别做了碳酸钠溶液和稀盐酸溶液的化学实验(如图).小明的实验中能观察到有气泡产生,小芳的实验中观察不到有气泡产生,对此意外现象,两位同学进行如下探究:
【提出问题】小芳的实验中为什么没有观察到明显现象?
【查阅资料】①碳酸钠和稀盐酸反应不仅可以生成二氧化碳,还可以生成碳酸氢钠.
②碳酸氢钠与氯化钙溶液混合不发生反应;而碳酸钠溶液与氯化钙溶液反应生成沉淀.
【设计实验】证明小芳实验的溶液中含有碳酸氢钠.
写出步骤①反应的化学方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl.
【实验反思】(1)Na2CO3溶液和盐酸溶液反应的生成物受到盐酸量的影响,稀盐酸过量(填“过量”或“不足”)时才有气泡冒出.
(2)当反应物的量不同时,产物可能不同,试另举一例:氧气足量时,碳燃烧生成二氧化碳,氧气不足时,碳燃烧生成一氧化碳.
 在学习盐酸的化学性质时,小明和小芳两位同学分别做了碳酸钠溶液和稀盐酸溶液的化学实验(如图).小明的实验中能观察到有气泡产生,小芳的实验中观察不到有气泡产生,对此意外现象,两位同学进行如下探究:
在学习盐酸的化学性质时,小明和小芳两位同学分别做了碳酸钠溶液和稀盐酸溶液的化学实验(如图).小明的实验中能观察到有气泡产生,小芳的实验中观察不到有气泡产生,对此意外现象,两位同学进行如下探究:【提出问题】小芳的实验中为什么没有观察到明显现象?
【查阅资料】①碳酸钠和稀盐酸反应不仅可以生成二氧化碳,还可以生成碳酸氢钠.
②碳酸氢钠与氯化钙溶液混合不发生反应;而碳酸钠溶液与氯化钙溶液反应生成沉淀.
【设计实验】证明小芳实验的溶液中含有碳酸氢钠.
| 实验步骤 | 实验现象 | 实验结论 |
| ①取上述溶液少量于试管中,加入足量的 CaCl2 (写化学式)溶液 | 产生白色沉淀 | 小芳实验的溶液中 含有碳酸氢钠 |
| ②取步骤①所得上层清液少量,滴加 稀盐酸 | 产生气泡 |
【实验反思】(1)Na2CO3溶液和盐酸溶液反应的生成物受到盐酸量的影响,稀盐酸过量(填“过量”或“不足”)时才有气泡冒出.
(2)当反应物的量不同时,产物可能不同,试另举一例:氧气足量时,碳燃烧生成二氧化碳,氧气不足时,碳燃烧生成一氧化碳.
18.某同学在实验室制取CO2时,进行了如下操作,其中错误的是( )
| A. |  检查气密性 | B. |  取用固体 | C. |  倾倒液体 | D. |  验满气体 |
2.硝酸铜是一种常见的试剂,在有机合成上也有应用.硝酸铜受热时发生如下反应:2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+O2↑+4X↑.下列有关说法不正确的是( )
| A. | 根据质量守恒定律可知X的化学式为NO2 | |
| B. | 该反应的基本反应类型为分解反应 | |
| C. | 反应前后有两种元素的化合价发生变化 | |
| D. | 将带火星的木条放入所收集到气体中,木条复燃,不能说明X支持燃烧 |
3.石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4g石灰石样品,把20g稀盐酸分4次加人样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:
稀盐酸的用(1)该石灰石样品中碳酸钙的质量分数是75%;
(2)计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)
| 稀盐酸的用量 | 第一次加入5 g | 第二次加入5 g | 第三次加入5 g | 第四次加人5 g |
| 剩余固体的质量 | 3 g | 2 g | l g | 1 g |
(2)计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)
 干冰是固态的二氧化碳,在常温下易升华,如图是干冰升华时的情景,根据图中信息,从“物质性质$?_{反映}^{决定}$物质用途”这一角度分析干冰具有的性质和用途.
干冰是固态的二氧化碳,在常温下易升华,如图是干冰升华时的情景,根据图中信息,从“物质性质$?_{反映}^{决定}$物质用途”这一角度分析干冰具有的性质和用途.