题目内容
2.如图是恒温下模拟海水晒盐过程是示意图,与丙烧杯溶液的溶质质量分数一定相同的是( )
| A. | 甲 | B. | 甲和乙 | C. | 乙和丁 | D. | 丁 |
分析 根据①溶液变化为②溶液,没有晶体析出,②转化成③后析出晶体,③④都是常温下氯化钠的饱和溶液进行解答.
解答 解:甲一定是不饱和溶液,乙可能是饱和溶液,也可能是不饱和溶液,但是由图象可知,丙和丁是该温度下的饱和溶液,在该温度下的饱和溶液中,溶质的质量分数=$\frac{溶解度}{溶解度+100g}×100%$,故二者溶液中的溶质质量分数相等.
故选D.
点评 本题涉及海水晒盐的原理、溶解度应用等理论内容,要通过该题认真总结.

练习册系列答案
相关题目
10.互为同素异形体的一组物质是( )
| A. | 金刚石、石墨 | B. | 双氧水、水 | C. | 干冰、冰 | D. | 氧气、液氧 |
17.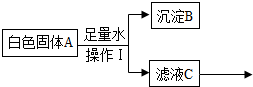 某白色固体A可能含有碳酸钠、氯化钡(水溶液呈中性),氢氧化钠中的一种或几种,进行如下实验.
某白色固体A可能含有碳酸钠、氯化钡(水溶液呈中性),氢氧化钠中的一种或几种,进行如下实验.
完成下列填空:
①操作Ⅰ是过滤,根绝上述实验分析,A中一定含有的物质是碳酸钠、氯化钡,C中一定含有的溶质是氯化钠.
②为进一步确定固体A中可能存在的物质,对滤液C进行实验,完成下表.
 某白色固体A可能含有碳酸钠、氯化钡(水溶液呈中性),氢氧化钠中的一种或几种,进行如下实验.
某白色固体A可能含有碳酸钠、氯化钡(水溶液呈中性),氢氧化钠中的一种或几种,进行如下实验.完成下列填空:
①操作Ⅰ是过滤,根绝上述实验分析,A中一定含有的物质是碳酸钠、氯化钡,C中一定含有的溶质是氯化钠.
②为进一步确定固体A中可能存在的物质,对滤液C进行实验,完成下表.
| 实验操作 | 现象 | 结论 |
| 向滤液C中加入足量的氯化钡溶液,充分反应后,静置,取上层清液滴加无色酚酞 | 无色酚酞变红色 | A中有氢氧化钠 |
7.用已知溶质质量分数的溶液可以测定未知溶液的质量分数,实验室有一瓶标签模糊的稀盐酸,某同学为了测定其溶质质量分数,进行了如下实验.
①取一洁净的锥形瓶称量,然后往其中加入一定量的稀盐酸,并滴入几滴紫色石蕊试液(质量忽略不计),重新称量);
②往上述锥形瓶中逐滴加入溶质质量分数为16%的氢氧化钠溶液,边滴加边振荡,当观察到溶液由红色恰好变为紫色时,停止滴加,再次称量,数据如下表:
(1)若要配制500克16%的氢氧化钠溶液,需要氢氧化钠固体80克;
(2)本次实验中,实际消耗的氢氧化钠溶液质量为25克;
(3)请通过计算确定该瓶稀盐酸的溶质质量分数;
(4)另有同学做了同样实验,却得到了不同的结果,于是用精密pH试纸测得反应后锥形瓶内溶液的pH为8.2,则他测出的盐酸溶质质量分数偏大(选填“偏大”或“偏小”),造成这一偏差的原因是滴加的氢氧化钠溶液过量.
①取一洁净的锥形瓶称量,然后往其中加入一定量的稀盐酸,并滴入几滴紫色石蕊试液(质量忽略不计),重新称量);
②往上述锥形瓶中逐滴加入溶质质量分数为16%的氢氧化钠溶液,边滴加边振荡,当观察到溶液由红色恰好变为紫色时,停止滴加,再次称量,数据如下表:
| 锥形瓶 | 锥形瓶+稀盐酸 | 锥形瓶+反应后溶液 | |
| 质量(克) | 35.5 | 55.5 | 80.5 |
(2)本次实验中,实际消耗的氢氧化钠溶液质量为25克;
(3)请通过计算确定该瓶稀盐酸的溶质质量分数;
(4)另有同学做了同样实验,却得到了不同的结果,于是用精密pH试纸测得反应后锥形瓶内溶液的pH为8.2,则他测出的盐酸溶质质量分数偏大(选填“偏大”或“偏小”),造成这一偏差的原因是滴加的氢氧化钠溶液过量.
7.利用下列各组物质之间的反应,能够验证Fe、Cu、Ag三种金属活动性顺序的是( )
| A. | Fe、CuCl2溶液、Ag | B. | FeCl2溶液、CuCl2溶液、Ag | ||
| C. | FeCl2溶液、Cu、AgNO3溶液 | D. | Fe、CuCl2溶液、AgNO3溶液 |
4.关于“C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2”的叙述,正确的是( )
| A. | 碳加氧气等于二氧化碳 | |
| B. | 碳加氧气生成二氧化碳 | |
| C. | 碳和氧气在点燃条件下生成二氧化碳 | |
| D. | 二氧化碳是反应物,碳和氧气是生成物 |
5.下表是NaCl和KNO3在不同温度时的溶解度:
(1)从表中数据可以看出NaCl和KNO3的溶解度随温度升高而增大(填“增大”或“减小”).
(2)若将KNO3的不饱和溶液变为相同温度下饱和溶液,其方法为加入硝酸钾固体(填一种).若KNO3饱和溶液中含有少量NaCl时,提纯的方法是冷却热饱和溶液(填一种).
(3)下列有关说法正确的是C.
A.40℃时,KNO3溶液的溶质质量分数一定比NaCl溶液的溶质质量分数大
B.KNO3饱和溶液中一定不能再溶解NaCl固体
C.从表中数据可以判断NaCl和KNO3的溶解度相等的温度在20-40℃之间.
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
(2)若将KNO3的不饱和溶液变为相同温度下饱和溶液,其方法为加入硝酸钾固体(填一种).若KNO3饱和溶液中含有少量NaCl时,提纯的方法是冷却热饱和溶液(填一种).
(3)下列有关说法正确的是C.
A.40℃时,KNO3溶液的溶质质量分数一定比NaCl溶液的溶质质量分数大
B.KNO3饱和溶液中一定不能再溶解NaCl固体
C.从表中数据可以判断NaCl和KNO3的溶解度相等的温度在20-40℃之间.



