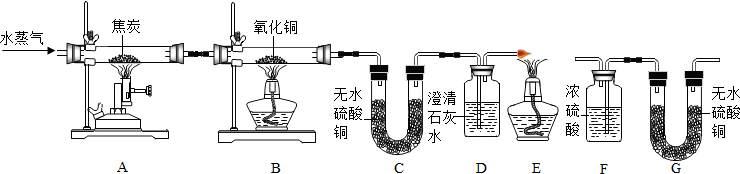
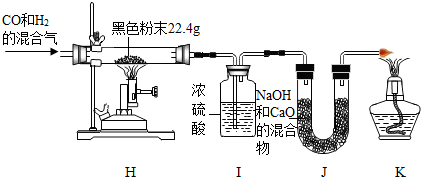
题目内容
3.某金属冶炼厂的管道烟泥中含有某些单质,其中Cu约占10.3%、Zn约占5.0%、S约占1.2%.现欲回收铜和锌,并对硫进行环保处理,主要步骤如图所示: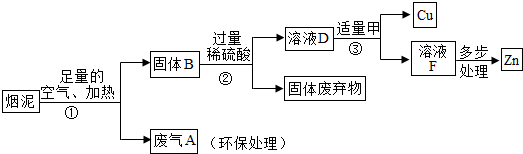
已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物.
(1)步骤①产生的废气A中,一定含有的有害气体是二氧化硫.
(2)步骤③中反应的化学方程式是Zn+H2SO4=ZnSO4+H2↑,Zn+CuSO4=ZnSO4+Cu.
(3)下列说法正确的是ad.
a.②、③中的操作均包含过滤
b.溶液D和溶液F中ZnSO4的质量相等
c.溶液D中ZnSO4的质量大于CuSO4的质量
d.若步骤①中空气不足量,不会导致锌的回收率降低.
分析 (1)根据烟泥中含有硫的单质,所以加热后会生成有毒气体二氧化硫进行分析;
(2)通过生成物的分析可以看出甲是锌反应时会置换出铜,并消耗溶液中的剩余硫酸;
(3)a、过滤是把固体和液体分开的操作;
b、溶液F中比溶液D中增多了ZnSO4;
c、Cu约占10.3%、Zn约占5.0%、溶液D中ZnSO4的质量不会大于CuSO4的质量;
d、空气量不足不会影响锌的回收,因为不管锌在第一步中是否被氧化,在第二步中都会完全转化为硫酸锌,不会影响锌的回收.
解答 解:(1)烟泥中存在单质硫,在空气中加热时会产生二氧化硫,二氧化硫是常见的空气污染物;
(2)由于生成物是铜与硫酸锌可知甲是锌,过量的锌除置换铜外还会消耗溶液中的剩余硫酸,所以会发生两个反应,即锌与硫酸铜反应生成硫酸锌和铜、锌与硫酸反应生成硫酸锌和氢气,化学方程式为:Zn+CuSO4═ZnSO4+Cu、Zn+H2SO4═ZnSO4+H2↑;
(3)a、过滤是把固体和液体分开的操作,故a正确;
b、溶液F中比溶液D中增多了ZnSO4,故b错误;
c、Cu约占10.3%、Zn约占5.0%、溶液D中ZnSO4的质量不会大于CuSO4的质量,故c错误;
d、空气量不足不会影响锌的回收,因为不管锌在第一步中是否被氧化,在第二步中都会完全转化为硫酸锌,不会影响锌的回收,故d正确.
故选:ad.
故答案为 (1)二氧化硫;
(2)Zn+H2SO4=ZnSO4+H2↑,Zn+CuSO4=ZnSO4+Cu;
(3)ad.
点评 此题是对物质分离与提纯的知识的考查,解决的重点是对每一步具体的反应做出详细的分析与判断,属基础性知识考查题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.已知CaO、CuO、SO2、CO等属于氧化物:NH3、CH4、HF、NaH、KH等属于氢化物.则下列说法中,错误的是( )
| A. | 氢化物可理解为由两种元素组成,其中一种是氢元素的化合物 | |
| B. | 水既属于氧化物又属于氢化物 | |
| C. | 硫酸既属于氧化物又属于氢化物 | |
| D. | 在氢化物中氢元素的化合价可能显+1价,也可能显-1价 |
5.下列叙述中,正确的是( )
| A. | 不锈钢是永不生锈的钢铁 | |
| B. | 用酒精清洗碘单质形成的污渍是乳化的应用 | |
| C. | 图书档案起火,用液态二氧化碳灭火器扑灭 | |
| D. | “墙内开花墙外香”主要说明构成物质的微粒间有空隙 |
15.某品牌洁厕灵是一种蓝色溶液,常用于清除厕所污垢.某化学兴趣小组对其为何显蓝色进行了如下探究.
【查阅资料】洁厕灵主要含有盐酸,厕所污垢主要包括尿碱、水锈(主要成分为三氧化二铁)和油污等.
【提出猜想】
猜想1:含有氯化铜;猜想2:含有某种酸碱指示剂.
【实验探究】
【反思与交流】
(1)欲测定该洁厕灵的酸碱度,最适宜选用的是A(填字母);
A.pH试纸 B.酚酞溶液 C.紫色石蕊溶液
(2)写出该洁厕灵去除水锈时所发生反应的化学方程式:Fe2O3+6HCl═2FeCl3+3H2O;
(3)月月认为,不用碱溶液也能探究猜想1,她的实验方案为:
【查阅资料】洁厕灵主要含有盐酸,厕所污垢主要包括尿碱、水锈(主要成分为三氧化二铁)和油污等.
【提出猜想】
猜想1:含有氯化铜;猜想2:含有某种酸碱指示剂.
【实验探究】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取样品加入过量氢氧化钠溶液,振荡 | 溶液颜色褪去,无蓝色沉淀生成 | 猜想1错误 |
| ②向①溶液中加入过量的稀盐酸,振荡 | 溶液颜色为蓝色 | 猜想2正确 |
(1)欲测定该洁厕灵的酸碱度,最适宜选用的是A(填字母);
A.pH试纸 B.酚酞溶液 C.紫色石蕊溶液
(2)写出该洁厕灵去除水锈时所发生反应的化学方程式:Fe2O3+6HCl═2FeCl3+3H2O;
(3)月月认为,不用碱溶液也能探究猜想1,她的实验方案为:
| 实验步骤 | 实验现象 | 实验结论 |
| 取样,向样品中加铁片 | 产生大量气泡且无红色固体析出 | 猜想1错误 |