题目内容
9.高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂,高铁酸钾受热时发生的反应应为4K2FeO$\frac{\underline{\;\;△\;\;}}{\;}$2R+4K2O+3O2↑,则R的化学式是( )| A. | Fe2O3 | B. | FeO | C. | Fe3O4 | D. | Fe6O8 |
分析 根据质量守恒定律,反应前后原子的种类及数目不变分析R的化学式.
解答 解:根据反应的化学方程式4K2FeO4$\frac{\underline{\;\;△\;\;}}{\;}$2R+4K2O+3O2↑,反应物中钾、铁、氧原子个数分别为8、4、16,反应后的生成物中钾、铁、氧原子个数分别为8、0、10,根据反应前后原子种类、数目不变,则2R中含有4个铁原子和6个氧原子,则每个R分子由2个铁原子和3个氧原子构成,则物质R的化学式为Fe2O3.
故选A
点评 本题考查了质量守恒定律的应用,在化学反应前后原子的种类及数目不变.

练习册系列答案
相关题目
19.一定条件下甲和乙反应生成丙.结合微观示意图分析,下列说法正确的是( )

| A. | 反应前后分子总数不变 | |
| B. | 参加反应的甲和乙的质量比为15:16 | |
| C. | 该反应涉及三种氧化物 | |
| D. | 消耗的甲和生成的丙的分子个数比为1:1 |
17.完全中和一定质量的稀硫酸,需要质量分数为8%的氢氧化钾溶液100g,若改用8%的氢氧化钠溶液来中和等质量的该稀硫酸,需要氢氧化钠溶液的质量( )
| A. | 小于100g | B. | 大于100g | C. | 等于100g | D. | 无法确定 |
1.现取镁和碳酸镁组成的固体混合物13.2g,加入171.6g稀硫酸中,恰好完全反应.得到4.8g气体和溶质质量分数为20%的溶液.则原固体混合物中镁元素质量为( )
| A. | 9.6 g | B. | 7.2 g | C. | 4.8 g | D. | 3.6 g |


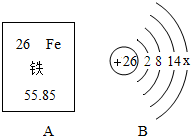 2014年以来,郑欧班列累计开行20班,综合影响力居国内亚欧班列首位,对于打通亚欧经济大动脉,推进沿线国家和地区经济发展有重要的意义.在建设郑欧班列的主要材料中,钢铁发挥了巨大的作用.
2014年以来,郑欧班列累计开行20班,综合影响力居国内亚欧班列首位,对于打通亚欧经济大动脉,推进沿线国家和地区经济发展有重要的意义.在建设郑欧班列的主要材料中,钢铁发挥了巨大的作用. 第二十届世界杯足球赛正在巴西如火如荼地举行,吸引着全球亿万球迷的目光.
第二十届世界杯足球赛正在巴西如火如荼地举行,吸引着全球亿万球迷的目光. 以下是有关金属性质的探究实验.
以下是有关金属性质的探究实验. 冬季市场上热销一种叫“暖宝宝”取暖贴.取暖贴的持续放热可以促进人体微循环,恢复正常的生理机能,从而消除疼痛,治疗疾病.对关节炎、肩周炎、腰腿痛等病痛都有很好的效果的.右图是某“取暖片”外包装的图片.该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热.
冬季市场上热销一种叫“暖宝宝”取暖贴.取暖贴的持续放热可以促进人体微循环,恢复正常的生理机能,从而消除疼痛,治疗疾病.对关节炎、肩周炎、腰腿痛等病痛都有很好的效果的.右图是某“取暖片”外包装的图片.该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热.