题目内容
11.写出下列反应方程式:镁条与稀盐酸反应:Mg+2HCl═MgCl2+H2↑
铁与稀硫酸反应:Fe+H2SO4═FeSO4+H2↑
氧化铁与稀盐酸Fe2O3+6HCl═2FeCl3+3H2O
硝酸银溶液与稀盐酸HCl+AgNO3═AgCl↓+HNO3
氯化钡溶液与稀硫酸BaCl2+H2SO4═BaSO4↓+2HCl
碳酸钠与稀硫酸Na2CO3++H2SO4═Na2SO4+H2O+CO2↑.
分析 镁条与稀盐酸反应生成氯化镁和氢气;
铁与稀硫酸反应生成硫酸亚铁和氢气;
氧化铁与稀盐酸反应生成氯化铁和水;
硝酸银溶液与稀盐酸反应生成氯化银和硝酸;
氯化钡溶液与稀硫酸反应生成硫酸钡和盐酸;
碳酸钠与稀硫酸反应生成硫酸钠、水和二氧化碳.
解答 解:镁条与稀盐酸反应的化学方程式为:Mg+2HCl═MgCl2+H2↑;
铁与稀硫酸反应的化学方程式为:Fe+H2SO4═FeSO4+H2↑;
氧化铁与稀盐酸反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O;
硝酸银溶液与稀盐酸反应的化学方程式为:HCl+AgNO3═AgCl↓+HNO3;
氯化钡溶液与稀硫酸反应的化学方程式为:BaCl2+H2SO4═BaSO4↓+2HCl;
碳酸钠与稀硫酸反应的化学方程式为:Na2CO3++H2SO4═Na2SO4+H2O+CO2↑.
故填:Mg+2HCl═MgCl2+H2↑;Fe+H2SO4═FeSO4+H2↑;Fe2O3+6HCl═2FeCl3+3H2O;HCl+AgNO3═AgCl↓+HNO3;BaCl2+H2SO4═BaSO4↓+2HCl;
Na2CO3++H2SO4═Na2SO4+H2O+CO2↑.
点评 书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列物质在氧气中燃烧的现象,错误的是( )
| A. | 红磷在氧气中燃烧时,放出大量的热,产生大量白烟 | |
| B. | 木炭在氧气中燃烧时,发出耀眼白光,生成一种无色有刺激性气味的气体 | |
| C. | 铁丝在氧气中剧烈燃烧时,火星四射,放出大量的热,生成黑色固体 | |
| D. | 硫粉在氧气中燃烧时,发出蓝紫色火焰,放出大量的热,闻到刺激性气味 |
19.下列说法不正确的是( )
| A. | 食盐除可用作调味品外,还是一种重要的化工原料 | |
| B. | 火的发现和利用,改善了人类的生存条件 | |
| C. | “白色污染”造成地下水及土壤污染,妨碍植物生长,危及人们的健康 | |
| D. | 学习化学最重要的途径是背书做习题 |
6.下列不属于缓慢氧化的是( )
| A. | 动物呼吸 | B. | 米酒酿造 | C. | 食物腐败 | D. | 光合作用 |
1. 如图是钙原子的结构示意图,下列有关钙原子的叙述正确的是( )
如图是钙原子的结构示意图,下列有关钙原子的叙述正确的是( )
 如图是钙原子的结构示意图,下列有关钙原子的叙述正确的是( )
如图是钙原子的结构示意图,下列有关钙原子的叙述正确的是( )| A. | 核外共有5个电子层 | |
| B. | 在化学反应中不易失去电子 | |
| C. | 核内外电子总数是40 | |
| D. | 易失去最外层的2个电子,形成带2个单位正电荷的阳离子Ca2+ |
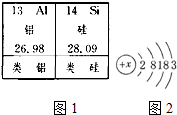 阅读材料,回答问题.
阅读材料,回答问题.