题目内容
1.某兴趣小组的同学要用纯净干燥的一氧化碳测定由铜和氧化铜组成的混合物中氧化铜的质量,实验装置和实验数据如下.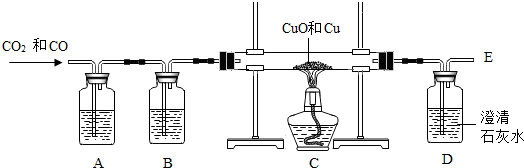
(1)B装置中的试剂是浓硫酸,起干燥作用..
(2)在E处应该点燃,因为CO有毒,防止污染空气,化学反应方程式2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2.
| C处玻璃管+样品的质量 | D装置的总质量 | |
| 反应前 | 158.2g | 246.8g |
| 反应后 | 156.6g | 251.4g |
(4)根据D装置反应前后质量的变化,生成二氧化碳的质量是4.6g,原混合物中氧化铜的质量约是8.4g(结果保留一位小数).
(5)从(3)、(4)两小题中计算得出的氧化铜的质量不同,请分析原因可能是A中CO2没有全部除去.
分析 (1)为得到干燥的气体,装置B内应放入液体干燥剂;浓硫酸具有吸水性,常用于除去气体混合物中的水;
(2)E处放出的尾气是由通入的混合气体发生反应后的剩余气体及未完全反应的气体;气体中混有有毒气体CO,需要进行燃烧处理;
(3)装置C内的氧化铜与混合气体中的CO发生反应,CO夺取氧化铜中的O而使装置C失去O造成质量减小;装置C反应前后的质量差即为氧化铜中氧的质量,利用氧化铜的质量=$\frac{氧元素质量}{氧化铜中氧元素的质量分数}$,求出氧化铜的质量;
(4)装置D因吸收二氧化碳而造成质量增加,装置D反应前后的质量差即为反应生成二氧化碳的质量;根据反应的化学方程式,利用二氧化碳的质量计算氧化铜的质量;
(5)分析装置及操作方法上存在的不足,判断出现测定质量差的原因.
解答 解:(1)要得到干燥的气体,需要在B装置内加入具有吸水性的浓硫酸;
故答案为:浓硫酸;干燥;
(2)未完全反应的毒气体CO从E处排出会造成空气污染,利用其可燃性将其点燃生成不污染空气的二氧化碳;化学方程式为:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2;
故答案为:CO有毒,防止污染空气;2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2;
(3)C装置中氧化铜中的氧被CO夺取,因失氧而使质量减小,因此装置C前后质量差即氧化铜中氧的质量=158.2g-156.6g=1.6,
则氧化铜的质量=$\frac{1.6g}{\frac{16}{80}×100%}$═8g;
故答案为:1.6;8;
(4)装置D中澄清石灰水吸收混合气体中的二氧化碳生成碳酸钙和水,装置质量增加;反应前后装置质量差即为生成二氧化碳气体的质量=251.4g-246.8g=4.6g;
设生成4.6g二氧化碳时参加反应的氧化铜的质量为x
CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2
80 44
x 4.6g
$\frac{80}{x}=\frac{44}{4.6g}$
x≈8.4g
故答案为:4.6;8.4;
(5)两次计算氧化铜的质量关系8g<8.36g,二氧化碳质量偏大的结果,造成二氧化碳质量偏大的原因原混合气体中的二氧化碳没有完全除去的结果;
故答案为:A中CO2没有全部除去.
点评 利用测定氧化铜失去氧而剩余固体的质量与氧化铜的质量差所求得的氧化铜的质量分数,要比利用测定的二氧化碳质量进行计算更准确,原因就在于反应所产生二氧化碳是否能做到完全吸收以及是否吸收了空气中的二氧化碳.

 名校课堂系列答案
名校课堂系列答案| A. |  | B. |  | C. |  | D. |  |
| A. | 石墨和C60 | B. | 汞和水银 | C. | 氧气和液氧 | D. | 冰和干冰 |
| A. | Mg+O2═MgO2 | B. | Cu2(OH)2CO3═2CuO+H2O+CO2↑ | ||
| C. | H2O2=H2↑+O2↑ | D. | CO2+Ca(OH)2═CaCO3↓+H2O |
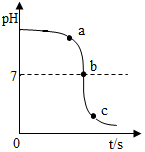 某校化学小组在利用稀硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象,如图所示,下列说法正确的是( )
某校化学小组在利用稀硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象,如图所示,下列说法正确的是( )| A. | 图中c点所示溶液呈碱性 | |
| B. | 图中a点所示溶液中,含有的溶质是Na2SO4和NaOH | |
| C. | 若将实验中的稀硫酸改为其溶质质量分数相同的稀盐酸,恰好完全反应时消耗稀盐酸质量小于稀硫酸 | |
| D. | 由a点到b点的pH变化过程证明酸和碱发生了中和反应 |
| A. |  | B. |  | C. |  | D. |  |



