题目内容
16.在宏观、微观和符号之间建立联系是学习化学的特点
(1)氢氧化铝可治疗胃酸过多,请完成反应方程式Al(OH)3+3HCl═AlCl3+3H2O,该反应属于复分解反应(填基本反应类型)
(2)A、B、C三种粒子的结构示意图如图所示:当A、B为原子时,x=8;y=1.C表示的粒子的符号是Cl-.
分析 氢氧化铝能和胃酸中的盐酸反应生成氯化铝和水;
原子中,核内质子数=核外电子数.
解答 解:(1)由质量守恒定律可知,反应前后氢原子都是6个,氧原子都是3个,反应前铝原子是1个,反应后应该是1个,反应前氯原子是3个,反应后应该是3个,因此未知物质是AlCl3,反应的化学方程式为:Al(OH)3+3HCl═AlCl3+3H2O,属于复分解反应.
故填:AlCl3;复分解.
(2)当A、B为原子时,原子中,核内质子数=核外电子数,因此x=8;y=1;
C表示的粒子是氯离子,氯离子的符号是Cl-.
故填:8;1;Cl-.
点评 化学反应遵循质量守恒定律,即反应前后元素种类不变,原子种类、总个数都不变,要注意理解.

练习册系列答案
相关题目
7. 某化学兴趣小组同学向一定体积10%的氢氧化钠溶液样品中滴加10%的盐酸,反应中溶液pH的变化记录如下,根据表中数据分析:
某化学兴趣小组同学向一定体积10%的氢氧化钠溶液样品中滴加10%的盐酸,反应中溶液pH的变化记录如下,根据表中数据分析:
(1)当加入盐酸体积为10mL时,表明NaOH与HCl恰好完全反应.此判断的依据是溶液pH=7.0.
(2)当加入14mL盐酸时,烧杯中溶液中含有的溶质有酚酞和氯化钠、氯化氢.
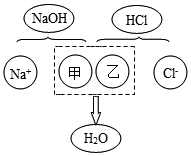
(3)酸与碱中和反应的结果是酸和碱各自的特性都消失.如图描述的是氢氧化钠与盐酸反应的微观实质,请从微观的角度分析,甲、乙处应填入的化学符号依次是OH-、H+.
 某化学兴趣小组同学向一定体积10%的氢氧化钠溶液样品中滴加10%的盐酸,反应中溶液pH的变化记录如下,根据表中数据分析:
某化学兴趣小组同学向一定体积10%的氢氧化钠溶液样品中滴加10%的盐酸,反应中溶液pH的变化记录如下,根据表中数据分析:| 加入盐酸的体积 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液pH | 12.5 | 10.8 | 9.7 | 8.5 | 7.0 | 6.2 | 5.3 | 4.2 | 3.1 | 2.6 |
(2)当加入14mL盐酸时,烧杯中溶液中含有的溶质有酚酞和氯化钠、氯化氢.
(3)酸与碱中和反应的结果是酸和碱各自的特性都消失.如图描述的是氢氧化钠与盐酸反应的微观实质,请从微观的角度分析,甲、乙处应填入的化学符号依次是OH-、H+.
4.下列图示与对应的叙述相符合的是( )
| A. |  a表示氢元素 | |
| B. |  将一瓶浓盐酸敞口放置在空气中溶质质量分数的变化 | |
| C. |  稀盐酸滴加到氢氧化钠溶液中溶液的温度变化 | |
| D. |  碱滴加到酸中溶液的pH变化 |
8.往盐酸溶液里加入一定量的氢氧化钠溶液,无任何明显现象.以下实验操作一定可证明二者确实发生了反应的是( )
| A. | 测量混合前后溶液的pH值,发现混合后溶液的pH值升高了 | |
| B. | 往反应后溶液中加入酚酞,发现酚酞变红 | |
| C. | 往反应后溶液中滴加硝酸银溶液,出现了白色沉淀 | |
| D. | 往反应后溶液中加入金属锌,无任何现象 |
5.在氢氧化钠溶液中加入一定量的稀盐酸后,下列实验能证明两者恰好完全反应的是( )
| A. | 滴入适量AgNO3溶液和稀硝酸,观察到有白色沉淀 | |
| B. | 滴入适量FeCl3溶液,溶液变黄,但无沉淀生成 | |
| C. | 滴入几滴酚酞试液,酚酞试液不变色 | |
| D. | 测得反应后溶液中Na+与Cl-的个数比为1:1 |
6.下列关于燃烧和灭火的分析错误的是( )
| A. | 室内着火不能立即打开门窗,是因为会提供充足的氧气 | |
| B. | 点燃的火柴竖直向上,火焰很快熄灭,是因为它接触不到氧气 | |
| C. | 扑灭森林火灾铲除前方树木设置隔离带,是因为清除了可燃物 | |
| D. | 在生煤炉时,可点燃木材来引燃煤,是因为木材的着火点比煤低 |
 实验室进行科学探究是化学学习的重要方式.请填写下列空格:
实验室进行科学探究是化学学习的重要方式.请填写下列空格: