题目内容
7. 某化学兴趣小组同学向一定体积10%的氢氧化钠溶液样品中滴加10%的盐酸,反应中溶液pH的变化记录如下,根据表中数据分析:
某化学兴趣小组同学向一定体积10%的氢氧化钠溶液样品中滴加10%的盐酸,反应中溶液pH的变化记录如下,根据表中数据分析:| 加入盐酸的体积 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液pH | 12.5 | 10.8 | 9.7 | 8.5 | 7.0 | 6.2 | 5.3 | 4.2 | 3.1 | 2.6 |
(2)当加入14mL盐酸时,烧杯中溶液中含有的溶质有酚酞和氯化钠、氯化氢.
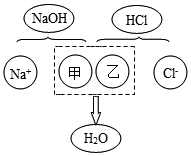
(3)酸与碱中和反应的结果是酸和碱各自的特性都消失.如图描述的是氢氧化钠与盐酸反应的微观实质,请从微观的角度分析,甲、乙处应填入的化学符号依次是OH-、H+.
分析 氢氧化钠显碱性,能和稀盐酸反应生成氯化钠和水;
酸碱中和反应的实质是氢离子和氢氧根离子结合生成水.
解答 解:(1)当加入盐酸体积为10mL时,表明NaOH与HCl恰好完全反应.此判断的依据是溶液pH=7.0.
故填:10;溶液pH=7.0.
(2)当加入14mL盐酸时,反应后稀盐酸过量,烧杯中溶液中含有的溶质有酚酞和氯化钠、氯化氢.
故填:氯化钠、氯化氢.
(3)从微观的角度分析,甲、乙处应填入的化学符号依次是OH-、H+.
故填:OH-;H+.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
14.常见金属X与硝酸银溶液反应的化学方程式为X+3AgNO3═3Ag+X(NO3)3,有关该反应说法中错误的是( )
| A. | 该反应是置换反应 | B. | 金属活动性X>Ag | ||
| C. | X可能是铁 | D. | X表面有固体覆盖 |
11.如图所示的实验操作中,正确的是( )
| A. |  给液体药品加热 | B. |  除去水中的泥沙 | C. |  取用液体药品 | D. |  读出液体的体积 |
12.空气是一种宝贵的自然资源.下列对空气的说法中正确的是( )
| A. | 洁净无尘的空气是纯净物 | |
| B. | 香肠采用真空包装的主要目的是为了隔绝水蒸气 | |
| C. | 植物的光合作用是空气中氧气的主要来源 | |
| D. | “富氧空气”中氧气含量高于普通空气,其中氧气与其他气体体积比为21:79 |