题目内容
19.图A是两种元素在元素周期表中的信息,图B是氟原子的原子结构示意图.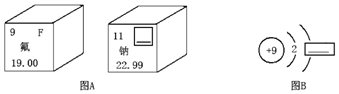
(1)图 A方框的横线上填的是Na,图 B方框的横线上的数字是7.
(2)氟原子的相对原子质量为19.00,氟元素与钠元素组成化合物的化学式为NaF.
分析 (1)根据图中信息可知,图A中右上角是元素符号,图B方框上是最外层电子数来解答;
(2)根据元素周期表中下方的数字表示相对原子质量以及化合物的化学式的写法来分析.
解答 解:(1)图A中带方框的元素是钠元素,其元素符号为:Na;图B代表的是氟原子,原子中质子数等于核外电子数,其最外层电子数为7;故填:Na;7;
(2)从图A中可以看出氟元素的相对原子质量是19,氟原子的最外层有7个电子,在化学反应中易得到一个电子而显-1价,钠原子的最外层有1个电子,在化学反应中易失去一个电子而+1价,所以氟化钠的化学式为NaF;故填:故填:19.00;NaF.
点评 了解元素周期表的特点及其应用,以及原子结构示意图的信息是解题的关键.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
9.某化工厂用石灰石和废铜屑等设计生产石青、波尔多液的工艺流程如下:
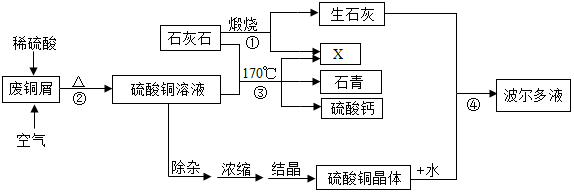
一、产品制备
(1)流程图中X的化学式为CO2;
(2)反应②的总化学方程式为2H2SO4+2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;
(3)硫酸铜晶体(CuSO4•5H2O)的溶解度如下表:
蒸发浓缩后热溶液经处理大量析出晶体,温度到达30℃时,剩余硫酸铜溶液的溶质质量分数为20%;待结晶完毕后,滤出晶体,用少量冰水洗涤2-3次,用冰水洗涤的目的是:
Ⅰ是除去晶体表面的杂质;Ⅱ是0℃时,硫酸铜溶解度较小,损失少.
(4)反应④中硫酸铜、生石灰和水制备波尔多液,其化学方程式为:
Ⅰ是CaO+H2O═Ca(OH)2;Ⅱ是Ca(OH)2+CuSO4═CaSO4+Cu(OH)2↓.
二、组成测定
查阅资料得知,石青的化学式可表示为aCuCO3•bCu(OH)2,已知Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃.为测定其组成,小组同学称取石青样品34.6g,用如图装置进行实验.
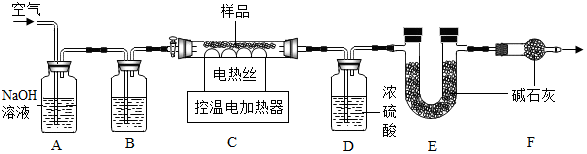
(5)洗气瓶A中氢氧化钠溶液的作用是除去空气中的二氧化碳;B中所装液体为浓硫酸.
(6)现控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止,再缓缓通入一段时间空气后,冷却后装置D增重1.8g,装置E增重8.8g.通过计算可得:a:b=2:1..
(7)若缺少F装置,测得的a:b偏大(选填“偏大”、“偏小”、“不变”).
三、脱水探究
硫酸铜晶体受热会逐步失去结晶水.取纯净CuSO4•5H2O固体2.50g,放在如图实验装置C中进行加热,测定固体质量随温度的变化情况如图所示.
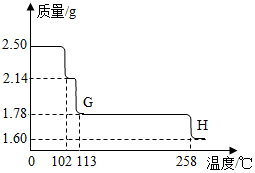
(8)G点固体的化学式是CuSO4•H2O.
(9)G→H看到的现象是白色.
(10)将CuSO4•5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuO+SO3↑+5H2O↑.

一、产品制备
(1)流程图中X的化学式为CO2;
(2)反应②的总化学方程式为2H2SO4+2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;
(3)硫酸铜晶体(CuSO4•5H2O)的溶解度如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| 溶解度/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 | 40.0 | 55.0 | 75.4 |
Ⅰ是除去晶体表面的杂质;Ⅱ是0℃时,硫酸铜溶解度较小,损失少.
(4)反应④中硫酸铜、生石灰和水制备波尔多液,其化学方程式为:
Ⅰ是CaO+H2O═Ca(OH)2;Ⅱ是Ca(OH)2+CuSO4═CaSO4+Cu(OH)2↓.
二、组成测定
查阅资料得知,石青的化学式可表示为aCuCO3•bCu(OH)2,已知Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃.为测定其组成,小组同学称取石青样品34.6g,用如图装置进行实验.

(5)洗气瓶A中氢氧化钠溶液的作用是除去空气中的二氧化碳;B中所装液体为浓硫酸.
(6)现控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止,再缓缓通入一段时间空气后,冷却后装置D增重1.8g,装置E增重8.8g.通过计算可得:a:b=2:1..
(7)若缺少F装置,测得的a:b偏大(选填“偏大”、“偏小”、“不变”).
三、脱水探究
硫酸铜晶体受热会逐步失去结晶水.取纯净CuSO4•5H2O固体2.50g,放在如图实验装置C中进行加热,测定固体质量随温度的变化情况如图所示.

(8)G点固体的化学式是CuSO4•H2O.
(9)G→H看到的现象是白色.
(10)将CuSO4•5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuO+SO3↑+5H2O↑.
10.甲和乙可以合成清洁燃料丙,微观过程如图.下列说法错误的是( )

| A. | 丁的化学式为H2O | B. | 丙中C、H、O的质量比为12:3:8 | ||
| C. | 该反应中有三种氧化物 | D. | 参加反应的甲和乙的质量比是7:1 |
14.韭菜是一种含铁量很高的蔬菜,每100克韭菜中含铁 8.9毫克.这里的“铁”指的是( )
| A. | 铁元素 | B. | 铁单质 | C. | 氧化铁 | D. | 铁的化合物 |
4.CaC6是纯钙晶体与石墨发生化学反应所得到的石墨烯插层复合材料,由单层碳原子石墨烯和单层原子钙交替复合而成,具有超导性能,下列有关说法正确的是( )
| A. | CaC6是由分子构成的 | B. | 构成CaC6的粒子停止运动 | ||
| C. | CaC6是纯净物 | D. | CaC6中原子间没有间隔 |
11.下列物质加入水中显著地放热的是( )
| A. | 固体氢氧化钠 | B. | 生石灰 | C. | 无水乙醇 | D. | 固体硝酸铵 |
9.许多物质都有俗称,下列物质的名称、俗名以及化学式对应关系正确的是( )
| A. | 石灰石,生石灰,CaO | B. | 氢氧化钙,消石灰,Ca(OH)2 | ||
| C. | 碳酸钙,火碱,Na2CO3 | D. | 纯碱,苛性钠,NaOH |
