题目内容
18.现将一种含杂质的锌粒(杂质不与盐酸反应)4g投入盛有足量80g稀盐酸的烧杯中,完全反应后,烧杯中剩余物质的质量为83.9g,求这种锌粒的纯度?(Zn+2HCl=ZnCl2+H2↑)分析 锌和稀盐酸反应生成氯化锌和氢气,由质量守恒定律,烧杯内质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出参加反应锌的质量,进而计算出这种锌粒的纯度.
解答 解:由质量守恒定律,生成氢气的质量为4g+80g-83.9g=0.1g.
设参加反应的锌的质量为x
Zn+2HCl=ZnCl2+H2↑
65 2
x 0.1g
$\frac{65}{2}=\frac{x}{0.1g}$ x=3.25g.
这种锌粒的纯度为$\frac{3.25g}{4g}$×100%=81.25%.
答:这种锌粒的纯度为81.25%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
3.石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4g石灰石样品,把20g稀盐酸分4次加入样品中(样品中碳酸钙除外,其余成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:
(1)碳酸钙中钙元素的质量分数为40%;
(2)m值是1.2;
(3)这种样品中碳酸钙的质量分数为70%;
(4)实验室现要制取二氧化碳44g,需这种纯度的石灰石的质量为多少g?
| 稀盐酸的用量 | 第一次加入5g | 第二次加入5g | 第三次加入5g | 第四次加入5g |
| 剩余固体的质量 | 3g | 2g | 1.2g | m g |
(2)m值是1.2;
(3)这种样品中碳酸钙的质量分数为70%;
(4)实验室现要制取二氧化碳44g,需这种纯度的石灰石的质量为多少g?
7.测定空气中氧气含量的实验装置如右图所示,下列说法正确的是( )
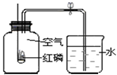

| A. | 实验中产生大量白雾 | |
| B. | 燃烧匙中的红磷可以换成木炭 | |
| C. | 本实验可以证明空气含有N2、O2、CO2和稀有气体 | |
| D. | 选用过量红磷是因为反应可以耗尽氧气,生成固态的P2O5 |
 如图在电解水实验中
如图在电解水实验中