题目内容
7.将10g部分变质的氢氧化钠固体全部溶于50g水中制成溶液,取此溶液30g加入适量的稀盐酸,共放出0.44g气体,求:(1)原混合物中氢氧化钠的质量分数;
(2)变质前氢氧化钠固体的质量.
分析 氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水,碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳;
根据生成二氧化碳的质量可以计算碳酸钠的质量,进一步可以计算原混合物中氢氧化钠的质量分数和变质前氢氧化钠固体的质量.
解答 解:设30g溶液中碳酸钠的质量为x,
Na2CO3+2HCl=2NaCl+H2O+CO2↑,
106 44
x 0.44g
$\frac{106}{x}$=$\frac{44}{0.44g}$,
x=1.06g,
60g溶液中碳酸钠的质量为:1.06g÷$\frac{1}{2}$=2.12g,
原混合物中氢氧化钠的质量分数为:$\frac{10g-2.12g}{10g}$×100%=78.8%,
设和二氧化碳反应的氢氧化钠质量为y,
2NaOH+CO2═Na2CO3+H2O,
80 106
y 2.12g
$\frac{80}{y}$=$\frac{106}{2.12g}$,
y=1.6g,
变质前氢氧化钠固体的质量为:1.6g+(10g-2.12g)=9.48g,
答:原混合物中氢氧化钠的质量分数为82.3%,变质前氢氧化钠固体的质量为9.57g.
点评 氢氧化钠暴露在空气中容易变质,因此要密封保存.

练习册系列答案
相关题目
15.某反应在密闭容器中进行,测得反应前后各物质的质量如表,分析并回答问题:
(1)物质中一定含有4种元素;
(2)该反应的基本反应类型是分解反应;
(3)反应中生成CO2和H2O的质量比为22:9.
| 物质 | 甲 | CuO | CO2 | H2O |
| 反应前质量/g | 待测 | 0 | 0.1 | 0.2 |
| 反应后质量/g | 0 | 16 | 4.5 | 2.0 |
(2)该反应的基本反应类型是分解反应;
(3)反应中生成CO2和H2O的质量比为22:9.
2.甲、乙两物质的溶解度与温度的关系如图所示,下列说法正确的是( )
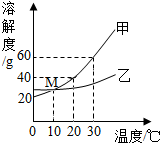

| A. | 30℃时乙的溶解度为60g | B. | 乙的溶解度随温度的升高而降低 | ||
| C. | 20℃时甲的溶解度小于乙的溶解度 | D. | M点表示10℃时两物质的溶解度相等 |
15.下列生活事例中主要过程为化学变化的是( )
| A. | 佳节到,焰火缤纷 | B. | 功夫深,铁杵磨成针 | ||
| C. | 春天来,冰雪融化 | D. | 美酒开,满屋飘香 |

 小明同学发现“旺旺雪饼”的包装袋内有一个“小纸袋”,上面写着“食品保鲜剂”,他很好奇,想和同学们对“食品保鲜剂”的成分进行探究.
小明同学发现“旺旺雪饼”的包装袋内有一个“小纸袋”,上面写着“食品保鲜剂”,他很好奇,想和同学们对“食品保鲜剂”的成分进行探究.

 如图是A、B、C三种物质的溶解度曲线,据图回答:
如图是A、B、C三种物质的溶解度曲线,据图回答: